
科目: 来源: 题型:
【题目】(1)实验室常用浓盐酸与高锰酸钾发生反应快速制备少量氯气,该反应的化学方程式为:![]() 用双线桥法表示该反应过程中的电子转移情况______________________,该反应中氧化剂为____________,HCl的作用是______________________。
用双线桥法表示该反应过程中的电子转移情况______________________,该反应中氧化剂为____________,HCl的作用是______________________。
(2)KMnO4能与热的经硫酸酸化的Na2C2O4反应,生成Mn2+和CO2,该反应的离子方程式是_________________________________。
(3)已知在碱性溶液中可发生如下反应![]() ,则
,则![]() 中R的化合价是________。
中R的化合价是________。
A.+3 B.+4 C.+5 D.+6
(4)填写下列空白:
①等物质的量的CO和CO2中:所含的分子数目之比为_______,相同条件下体积之比为_______,所含的原子总数目之比为_______。
②有下列物质:
a.硫酸 b.盐酸 c.氯气 d.硫酸钡 e.甲烷 f.铜 g.CH3COOH h.氯化氢 i.蔗糖 j.氨气 k.CO2 l.NaHCO3 m.Al(OH)3 n.NaOH溶液
其中属于非电解质的为_____________(填序号,下同。),属于电解质的为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)研究物质时会涉及物质的组成、分类、性质和用途等方面。
①Na2O2属于____________(填物质的类别),检验其组成中所含阳离子的方法是_____________。
②将包有少量____色Na2O2固体的棉花放在石棉网上,用滴管向棉花上滴几滴水,观察到的现象是__________________,由此得出的结论是_________________________________。
③在潜水艇和消防员的呼吸面具中,Na2O2所发生反应的化学方程式为_________________________,从氧化剂和还原剂的角度分析,在该反应中Na2O2的作用是___________________。某潜水艇上有25人,如果每人每分钟消耗的O2在标准状况下体积为0.80L(标准状况下O2的密度为1.429g/L),假设所需要的O2全部由Na2O2来提供,则该潜水艇一天所需要的Na2O2的物质的量是_____________。
(2)写出下列反应的离子方程式:
①NaHCO3溶于醋酸:__________________________________________________。
②过量CO2与NaOH溶液:_____________________________________________。
③工业制漂白液:______________________________________________________。
④生活中漂白粉的漂白原理:____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,其在电解质储罐和电池间不断循环。下列说法不正确的是
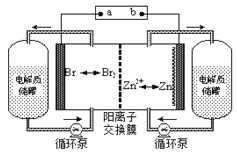
A. 放电时负极的电极反应式为Zn-2e-=Zn2+
B. 充电时电极a为电源的负极
C. 阳离子交换膜可阻止Br2与Zn直接发生反应
D. 放电时左侧电解质储罐中的离子总浓度增大
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,在A处通入氯气,关闭B阀时,C处的红布条看不到明显现象;当打开B阀后,C 处的红布条逐渐褪色。有以下几种溶液,则D瓶中盛放的溶液可能是
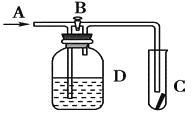
①浓硫酸 ②NaOH溶液 ③H2O ④饱和氯化钠溶液
A.①③B.①②C.②③D.②④
查看答案和解析>>
科目: 来源: 题型:
【题目】卤素及其化合物广泛存在于自然界中。回答下列问题:
(1)光气(COCl2)是一种重要的有机中间体,在农药、医药、工程塑料、聚氨酯材料以及军事上都有许多用途。光气的分子立体构型为______________,其三种元素的电负性由小到大的顺序为______________。与COCl2互为等电子体的分子和离子(各写一种)__________。
(2)日常生活中,看到的许多可见光,如霓虹灯,试从原子结构角度解释这一现象?____________________________。
(3)区分晶态二氧化硅和非晶态二氧化硅最可靠的科学方法是_____________。
(4)一种铜的溴化物晶胞结构如图所示,若将图中的Cu去掉,再把所有的Br换成Cu,得到晶体铜的晶胞结构,则晶体铜的堆积方式为___________,某同学将基态铜原子价电子错误的写为3d94s2,违背了核外电子排布规律中的______。

(5)下列关于上述铜的溴化物晶胞结构说法正确的是_________(选填字母序号)。
A.该化合物的化学式为CuBr2
B.铜的配位数为8
C.与每个Br紧邻的Br有12个
D.由图中P点和Q点的原子坐标参数,确定R点的原子坐标参数为(1/4,1/4,1/4)
(6)若图中P点和R点的原子核间距为a cm,NA为阿伏伽德罗常数的值,则该晶胞密度为______g/cm3。(列出计算式即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验装置设计正确、且能达到目的的是

A. 实验I:检查装置的气密性
B. 实验II:测定未知盐酸的浓度
C. 实验III:比较硫、碳、硅三种元素的非金属性强弱
D. 实验IV:定容
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,①和②为两个体积相同的固定容器,图中“”和“![]() ”分别表示氢原子和氧原子,则下列说法正确的是
”分别表示氢原子和氧原子,则下列说法正确的是
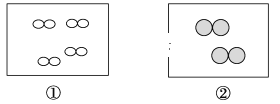
A.若①中的H2为1 mol,则②中所含分子总数为3.01×1023个
B.①和②中气体的质量之比为1∶4
C.H2、O2均能发生化合反应,但不能发生置换反应
D.两容器的温度和压强均相同
查看答案和解析>>
科目: 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是
A. O2和S2O32-是氧化剂,Fe2+是还原剂
B. 每生成1mol Fe3O4,则转移电子为2mol
C. 参加反应的氧化剂与还原剂的物质的量之比为1:1
D. 若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol
查看答案和解析>>
科目: 来源: 题型:
【题目】NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5 kJ/mol
2C(s)+O2(g)=2CO(g) △H=-221 kJ/mol
若某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式____________。
,请写出此反应的热化学方程式____________。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:_________________________。
(3)NO2用氨水吸收能生成NH4NO3,25℃时,将amolNH4NO3溶于水配成bL溶液,溶液显酸性,常温下向该溶液通入标准状况下VL氨气后溶液呈中性,则通入氨气的过程中水的电离平衡将_____(填“正向”“不”“逆向”)移动,通入标准状况下氨气的体积为_________L(设通入氨气后溶液的体积不变,用含a的代数式表示,已知常温下NH3·H2O的电离平衡常数为2.0×10-5)
(4)催化氧化法去除NO是在一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+6H2O不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如图所示:
5N2+6H2O不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如图所示:
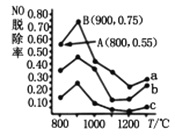
①由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降的原因可能是________。
②曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____________mg/(m3·s)。
③曲线c对应NH3与NO的物质的量之比是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种肼燃料电池的结构如图所示,下列说法正确的是( )
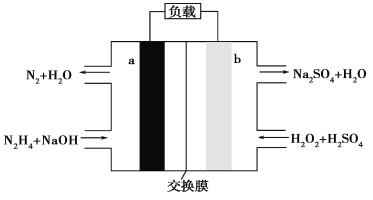
A. a极是正极,电极反应式为N2H4-4e-+4OH-=N2↑+4H2O
B. 电路中每转移NA个电子,就有1mol Na+穿过膜向正极移动
C. b极的电极反应式为H2O2+2e-=2OH-
D. 用该电池作电源电解饱和食盐水,当得到0.1mol Cl2时,至少要消耗0.1mol N2H4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com