
科目: 来源: 题型:
【题目】柠檬醛的结构简式如图所示,主要用作柠檬和什锦水果型香精,也是合成紫罗兰酮的主要原料

(1)柠檬醛不能发生的反应类型为_____________(填字母)。
A.酯化反应 B.加成反应 C.氧化反应 D.消去反应
(2)香叶醇经催化氧化可制得柠檬醛,则香叶醇的结构简式为_____________
(3)双羟基香茅酸(![]() 也是一种重要的香料,可由柠檬醛合成,合成路线如下
也是一种重要的香料,可由柠檬醛合成,合成路线如下

双羟基香茅酸的分子式为________,写出A→B的化学方程式___________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组用图甲装置制备了氯气,并进行了一系列实验。
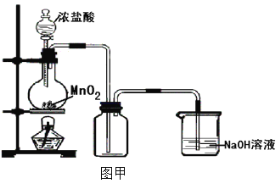
(1)实验室制备氯气的反应原理是_______________________
(2)若有87gMnO2参加反应,则被氧化的氯化氢的物质的量为____________;而实际收集的氯气量准是比理论值小,试写出其可能的一种原因____________
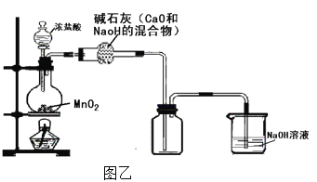
(3)乙同学认为图甲装置制备的氯气不纯净,其中混有HCl气体和水蒸气,对装置进行了如图乙改进。你认为合理吗?____________ (合理则填入“合理”二字,如不合理则用文字说明理由)
(4)将图甲装置合理改装后制取并收集一瓶氯气,将灼热的铁丝插到充满氯气的集气瓶中,看到铁丝在氯气中继续燃烧,在集气瓶内充满棕色的烟,烟的成分为反应方程式为____________
(5)另收集一瓶氯气并在集气瓶中加入水,观察到液体为浅黄绿色,有此现象的原因是____________;将溶液分成三份,分别加入一-定量的下列溶液,写出反应的方程式:
Na2CO3溶液____________
AgNO3溶液____________
KI溶液____________
(6)若实验中有少量的氯气散发到空气中,试设计方案将其检测出____________
查看答案和解析>>
科目: 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84g/cm3)配制100mL 1.0mol/L的稀硫酸,现给出下列仪器(配制过程中可能用到):
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.10mL量筒F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)需量取浓硫酸的体积为________mL
(2)实验时选用的仪器有________
(3)配制过程中,下列情况会使配制结果偏高的是________ (填序号)
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④量取浓硫酸时仰视量简刻度
⑤移液时未洗涤烧杯和玻璃棒
(4)在容量规使用方法中,下列操做不正确的是________ (填序号)
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶
D.将准确量取的18.4mol/L的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)以下为中学化学常见的几种物质①NaOH溶液②铜丝③液氯④盐酸⑤稀硫酸⑥氨水⑦CO2⑧熔融NaCl⑨蔗糖晶体⑩酒精。属于非电解质的是________,属于电解质的是________。
(2)工业上可用浓氨水检查氯气管道是否漏气。若有Cl2漏出,与浓氨水接触会有白烟生成,同时产生一种无毒、无可燃性、不污染大气的气体。有关的化学方程式是________:。该反应中氧化剂和还原剂的物质的量之比为________。
(3)铁酸钠(Na2FeO4)是水处理过程中一种新型的净水型,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+。
①配平制取铁酸钠的化学方程式:____Fe(NO3)3+____NaOH+ ____Cl2——____Na2FeO4 +____NaNO3+____NaCl+____H2O
②用单线桥法标出反应中电子转移的方向和数目____。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸是重要的化工材料,二氧化硫与氧气反应生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=0.040mol/L。
2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=0.040mol/L。
①从反应开始到达到平衡,用SO2表示的平均反应速率为________________
②从平衡角度分析采用过量O2的目的是____________;
③该反应的平衡常数表达式为K=___________。
④已知:K(300℃)>K(350℃),该反应是________(选填“吸”或“放”)热反应。若反应温度升高,SO2的转化率将_______(填“增大”、“减小”或“不变”)。

(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”,下同)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中颜色变化,直到加入一滴盐酸,溶液的颜色由____色变为_____,且半分钟不褪色,即停止滴定。
(2)下列操作中使所测氢氧化钠溶液的浓度数值偏高的是________(填序号)。

A、酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸
B、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥
C、酸式滴定管在滴定前有气泡,滴定后气泡消失
D、读取盐酸体积时,开始俯视读数,滴定结束时仰视读数
E、滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
(3)若滴定开始和结束时,酸式滴定管中的液面如右图所示:则起始读数为_____mL,终点读数为_____mL。
(4)如已知用c(HCl) = 0.1000 mol/L的盐酸滴定20.00 mL的氢氧化钠溶液,测得的实验数据如(3)中记录所示,则该氢氧化钠溶液的浓度c(NaOH) =____mo1/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】(CN)2、(SCN)2、(OCN)2称“类卤素”,与卤素单质的性质相似,而其阴离子性质也相似,如:2Fe + 3(SCN)2="==" 2Fe(SCN)3,2Fe + 3Cl2="==" 2FeCl3。以此判断下列化学方程式中错误的是
A.(CN)2+ H2O![]() HCN + HCNO
HCN + HCNO
B.(SCN)2+ 2Cu![]() 2CuSCN
2CuSCN
C.(OCN)2+ 2NaOH ="==" NaOCN + NaOCNO + H2O
D.MnO2+ 4HSCN(浓)![]() (SCN)2 + Mn(SCN)2+ 2H2O
(SCN)2 + Mn(SCN)2+ 2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,有![]() 盐酸;
盐酸;![]() 硫酸;
硫酸;![]() 醋酸三种酸的稀溶液
醋酸三种酸的稀溶液![]() 用a、b、c、
用a、b、c、![]() 、
、![]() 、
、![]() 号填写
号填写![]()
![]() 当其物质的量浓度相同时,
当其物质的量浓度相同时,![]() 由大到小的顺序是____________,
由大到小的顺序是____________,
![]() 同体积同物质的量浓度的三种酸,中和NaOH能力由大到小的顺序是____________,
同体积同物质的量浓度的三种酸,中和NaOH能力由大到小的顺序是____________,
![]() 当其
当其![]() 相同时,物质的量浓度由大到小的顺序为____________,
相同时,物质的量浓度由大到小的顺序为____________,
![]() 当
当![]() 相同、体积相同时,同时加入形状、质量、密度相同的锌,若产生相同体积的氢气
相同、体积相同时,同时加入形状、质量、密度相同的锌,若产生相同体积的氢气![]() 相同状况
相同状况![]() ,则开始时反应速率的大小关系是____________.
,则开始时反应速率的大小关系是____________.
![]() 将
将![]() 相同的三种酸均加水稀释至原来的10倍,
相同的三种酸均加水稀释至原来的10倍,![]() 由大到小的顺序为_____________.
由大到小的顺序为_____________.
查看答案和解析>>
科目: 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:

已知:3NO3-+ 8Al + 5OH- + 2H2O![]() 3NH3 + 8AlO2-
3NH3 + 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是
试样中肯定存在NH4+、Mg2+、SO42-和NO3-
试样中一定不含Al3+
试样中可能存在Na+、Cl-
该雾霾中可能存在NaNO3 、NH4Cl和MgSO4
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、CO32-,SO42-,现取三份100mL该溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.08mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是
A.K+一定存在
B.100mL溶液中含0.01mol CO32-
C.Cl—一定存在
D.Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com