
科目: 来源: 题型:
【题目】如图是某化工厂对海水资源综合利用的示意图。根据以上信息,判断下列相关分析不正确的是
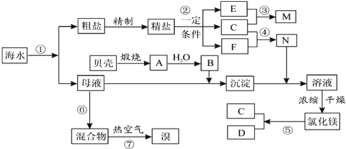
A.富集溴元素过程中,热空气吹出法利用了溴易挥发的性质
B.因氮气的化学性质相对稳定,冷却电解无水氯化镁所得的镁蒸气时,可选择氮气
C.反应⑥所用的气态氧化剂可从本厂生产烧碱处理循环利用或从本厂生产镁单质处理循环利用
D.MgCl2·6H2O必须在氯化氢氛围条件下加热制得无水氯化镁
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是______mol。
(2)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是________,又变为棕黄色的原因是用离子方程式解释___________________________.
(3)在100mLFeBr2溶液中通入标况下2.24LCl2,溶液溶液中有1/4的Br- 被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_________________。
(4)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应后溶液中溶质的化学式_________。向反应后的溶液中通入过量CO2,反应的离子方程式为______。
(5)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式___________,反应中生成0.2mol HNO3,转移的电子数目为_______。
②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是________
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )

A. 原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B. 反应最后形成的溶液中的溶质含AlCl3
C. 原溶液中Al3+与NH的物质的量之比为1∶3
D. 原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目: 来源: 题型:
【题目】铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为_____________________________,Cu位于元素周期表第ⅠB族。Cu 2+的核外电子排布式为____________________。
(2)胆矾CuSO4·5H2O可写成[Cu(H2O) 4 ]SO4 ·H2O,其结构示意图如下:
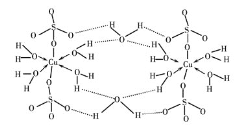
下列说法正确的是________(填字母)。
A.水中的氧原子采用sp3 杂化
B.氧原子参与形成配位键和氢键两种化学键
C.Cu2+的价电子排布式为3d84s1
D.胆矾中的水在不同温度下会分步失去
查看答案和解析>>
科目: 来源: 题型:
【题目】有五种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
E | L层上有2对成对电子 |
请根据表中信息填空:
(1)A原子的核外电子排布式为___________。
(2)B元素在周期表中的位置:__________________;离子半径:B___ A(填“大于”或“小于”)
(3)C原子的价电子排布图是___________,其原子核外有__________个未成对电子,能量最高的电子为___________轨道上的电子,其轨道呈___________形。
(4)D原子的电子排布式为___________。D-的结构示意图是________________
(5)C、E元素的第一电离能的大小关系是___________(用元素符号表示)。
(6)已知CD3分子中D元素为+1价,则C、D的电负性大小关系是________________(用元素符号表示),CD3与水反应后的产物是__________和__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表给出了14种元素的电负性:
元素 | 电负性 | 元素 | 电负性 | 元素 | 电负性 |
Al | 1.5 | B | 2.0 | Be | 1.5 |
C | 2.5 | Cl | 3.0 | F | 4.0 |
Li | 1.0 | Mg | 1.2 | N | 3.0 |
Na | 0.9 | O | 3.5 | P | 2.1 |
Cl | 2.5 | S | 1.8 |
(1)同一周期中,从左到右,主族元素的电负性_________;同一主族中,从上到下,元素的电负性_________。主族元素的电负性随原子序数递增呈_________变化。
(2)短周期元素中,电负性最大的元素与电负性最小的元素形成的化合物属于____________化合物,用电子式表示该化合物:___________________。
(3)已知:两成键元素间的电负性差值大于1.7时,通常形成离子键,两成键元素间的电负性差值小于1.7时,通常形成共价键,则Mg3N2、BeCl2、AlCl3、SiC中为离子化合物的是_________,为共价化合物的是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图,下列叙述错误的是( )
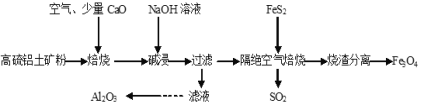
A.烧渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来
B.隔绝空气焙烧时理论上反应消耗的n(FeS2)∶n(Fe2O3)=1∶5
C.向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得Al2O3
D.加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A. NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B. CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C. H2O是极性分子,分子中O原子处在2个H原子所连成的直线的中央
D. CO2是非极性分子,分子中C原子处在2个O原子所连成的直线的中央
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的数目是
①12.0g熔融的NaHSO4中含有的阳离子数为0.2NA
②1mol Na2O 和Na2O2混合物中含有的阴、阴离子总数是3NA
③常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
④7.8g![]() 中含有的碳碳双键数目为0.3NA
中含有的碳碳双键数目为0.3NA
⑤用1L1.0 mol/LFeCl3溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目为NA
⑥1mol SO2与足量O2在一定条件下充分反应生成SO3,共转移2NA个电子
⑦在反应KIO3+6HI=KI+3I2 +3H2O 中,每生成3molI2转移的电子数为5NA
⑧常温常压下,17 g甲基(-14CH3)中所含的中子数为9NA
A. 3 B. 4 C. 5 D. 6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com