
科目: 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的五种短周期元素,其中C为第三周期简单离子半径最小的元素,0.1mol·L1A、B、D的最高价氧化物对应的水化物溶液加水稀释时溶液的pH变化情况如图,则下列说法中不正确的是

A. C制的容器可盛装A和D的最高价含氧酸的浓溶液
B. AE3、D2E2分子中所有原子最外层均达到8电子结构
C. B、D、E的单质或者化合物中都可能有能作漂白剂的物质
D. 工业上分别电解熔融的B与E、C与E形成的化合物制备B、C单质
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应4CuO![]() 2Cu2O+O2↑,其中Cu2O和CuO中氧元素的化合价均为-2价。关于该反应的叙述正确的是
2Cu2O+O2↑,其中Cu2O和CuO中氧元素的化合价均为-2价。关于该反应的叙述正确的是
A. O2是还原产物
B. 铜元素被还原,氧元素部分被氧化
C. Cu2O是氧化剂
D. 该反应中每生成1个O2,则转移2个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列9种物质:①氯气;②二氧化硫;③稀硫酸;④铁;⑤BaCl2固体;⑥氢氧化钾;⑦KNO3溶液;⑧酒精(C2H5OH);⑨氧化钙,请将上述物质按要求完成下列问题:
(1)用相应化学式填写下列空白:属于酸性氧化物的有_____________,属于碱性氧化物的有____________,属于电解质的是______,属于非电解质的是_______。(用序号填空)
(2)写出NaHCO3电离方程式:______
(3)用双线桥表示Cl2与二氧化硫的反应________
查看答案和解析>>
科目: 来源: 题型:
【题目】化学实验是化学学习的重要内容。根据你掌握的知识,完成下面内容。
![]() 实验室需要配制0.1 mol·L-1NaOH溶液230mL,请回答下列问题:
实验室需要配制0.1 mol·L-1NaOH溶液230mL,请回答下列问题:
![]() 应选择____mL的容量瓶,用天平称取____g NaOH。
应选择____mL的容量瓶,用天平称取____g NaOH。
![]() 溶解NaOH后的溶液需冷却到室温后方能转移入容量瓶中。若趁热转移会使溶液的浓度______(填“偏大”或“偏小”,下同);在洗涤烧杯和玻璃棒的过程中,每次洗涤液均需注入容量瓶,不能损失点滴液体,否则会导致溶液的浓度______。
溶解NaOH后的溶液需冷却到室温后方能转移入容量瓶中。若趁热转移会使溶液的浓度______(填“偏大”或“偏小”,下同);在洗涤烧杯和玻璃棒的过程中,每次洗涤液均需注入容量瓶,不能损失点滴液体,否则会导致溶液的浓度______。
![]() 有人认为,用这种方法只能配置0.1 mol·L-1的NaOH溶液,而无法得到0.1000 mol·L-1的NaOH溶液,你觉得他的理由是__________________________________________。
有人认为,用这种方法只能配置0.1 mol·L-1的NaOH溶液,而无法得到0.1000 mol·L-1的NaOH溶液,你觉得他的理由是__________________________________________。
![]() 选择下列实验方法分离物质,将分离方法的序号填在横线上。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
![]() 萃取分液
萃取分液 ![]() 升华
升华 ![]() 结晶
结晶 ![]() 过滤
过滤 ![]() 蒸馏
蒸馏 ![]() 分液
分液
![]() 分离饱和食盐水与沙子的混合物______;
分离饱和食盐水与沙子的混合物______;
![]() 从硝酸钾和氯化钠的混合液中获得硝酸钾______;
从硝酸钾和氯化钠的混合液中获得硝酸钾______;
![]() 从碘水中提取碘单质______;
从碘水中提取碘单质______;
![]() 分离水和汽油的混合物______;
分离水和汽油的混合物______;
![]() 分离
分离![]() 沸点为
沸点为![]() 和甲苯
和甲苯![]() 沸点为
沸点为![]() 的混合物______。
的混合物______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是

A. 气态氢化物的稳定性:R>W
B. X与Y可以形成原子个数比为1:1和1:2的两种离子化合物
C. 由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)3.01×1023个NH4+含有质子的物质的量是____ ,含有电子的物质的量是_____;
(2)200mL 2mol/L的Al2(SO4)3溶液中SO42﹣的物质的量浓度为_____ ;
(3)标准状况下,36g H2和O2组成的混合气体的体积是67.2L,则混合气体中H2和O2的体积比为______;
(4)标准状况下,将33.6LNH3溶于水配成500mL溶液,该溶液的物质的量浓度为____;
(5)已知1.505×1023个A气体分子的质量为31g,则A气体的摩尔质量是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH的数据如下表所示。现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:
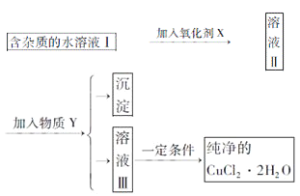
氢氧化物 | 开始沉淀pH | 完全沉淀pH |
Fe(OH)2 | 6.5 | 9.7 |
Fe(OH)3 | 1.5 | 3.7 |
Cu(OH)2 | 4.2 | 6.7 |
请回答下列问题:
(1)本实验最适合的氧化剂X是__________。(选填下面的序号)
A K2Cr2O7 B NaClO C H2O2 D KMnO4
(2)物质Y是________。
(3)本实验用加碱沉淀的目的是否能达到?________________。原因是________________。
(4)除去Fe3+的化学方程式为____________________,_________________________________。
(5)加氧化剂的目的为________________________。
(6)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________________。应如何操作________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是
A. 通常状况下,NA个Cl2分子的质量是71g
B. 通常状况下,NA个C02分子的体积约是22.4L
C. 0.1 mol/L的H2S04溶液中H+的个数是0.2NA
D. 若lg N2含有m个分子,则NA=m/28
查看答案和解析>>
科目: 来源: 题型:
【题目】物质的量是七大基本物理量之一,计算并回答下列问题:
(1)标准状况下,33.6LH2S的物质的量为___mol,质量为___g,所含H原子的数目为____;
(2)16g的O2和O3混合气体中含有O原子数目为____;
(3)1mol/L的BaCl2溶液0.5L中含有Ba2+的物质的量浓度为__mol/L,含有Cl—的物质的量为___mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com