
科目: 来源: 题型:
【题目】25℃时,下列有关叙述中不正确的是
A. pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH<7
B. 沉淀溶解平衡:BaSO4(s)![]() Ba2+(aq)+SO42-(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质
Ba2+(aq)+SO42-(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质
C. 在0.10molL﹣1的NH3H2O溶液中加入少量NH4Cl晶体,则NH3H2O电离被抑制,溶液pH减少
D. 0.1mol L-1的HA溶液pH=1,该溶液中由水电离的c(OH-)=l×10-13mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,电解质溶液的性质与变化是多样的,下列说法正确的是( )
A. pH相同的①CH3COONa ②NaClO ③NaOH三种溶液c(Na+)大小:①>②>③
B. 往稀氨水中加水,![]() 的值变小
的值变小
C. pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,存在下列等式:c(Na+)+c(H+)c=(OH—)+2c(S2—)
D. Ca(ClO)2溶液中通入少量CO2,ClO—水解程度增大,溶液碱性增强
查看答案和解析>>
科目: 来源: 题型:
【题目】已知T℃时AgCl的Ksp=2×1010;Ag2CrO4是一种橙红色固体,T℃时在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
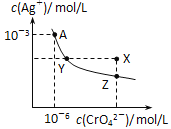
A. T℃时Ag2CrO4的Ksp=1×108
B. Y和Z点Ag2CrO4的Ksp不相同
C. 在饱和Ag2CrO4溶液中加入K2CrO4固体可使溶液由Y点到X点
D. 浓度均为2×106molL﹣1AgNO3与NaCl溶液等体积混合无沉淀生成
查看答案和解析>>
科目: 来源: 题型:
【题目】NaBH4燃料电池具有理论电压高、能量密度大等优点。以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是
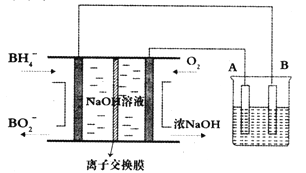
A. 离子交换膜应为阳离子交换膜,Na+由左极室向右极室迁移
B. 该燃料电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O
C. 电解池中的电解质溶液可以选择CuSO4溶液
D. 每消耗2.24LO2(标准状况)时,A电极的质量减轻12.8g
查看答案和解析>>
科目: 来源: 题型:
【题目】ag纯净的碳酸钠和ag碳酸钠与碳酸氢钠的混合物相比,下列描述正确的是( )
A.分别和盐酸反应时,混合物的耗酸量大
B.分别和足量盐酸反应时,混合物放出的CO2多
C.分别配制成等体积溶液,混合物碱性大
D.分别配制成等体积溶液,混合物的Na+的物质的量大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语对事实的表述正确的是
A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B.向Na2SiO3溶液中通入过量的SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32-
C.由Na和C1形成离子键的过程:![]()
D.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下列装置可以制备无水氯化铁。下列有关说法不正确的是( )
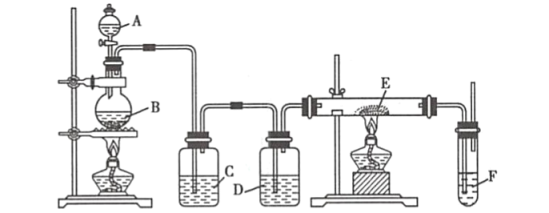
A.烧瓶B中制备氯气的反应物为二氧化锰和浓盐酸
B.装置C、D中分别盛有饱和食盐水和浓硫酸
C.装置D和装置E之间需要增加一个干燥装置,才能制得无水氯化铁
D.装置F的目的是吸收尾气
查看答案和解析>>
科目: 来源: 题型:
【题目】PbCl2是一种重要的化工材料,常用作助溶剂、制备铅黄等染料。工业生产中利用方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbCl2的工艺流程如下图所示。

已知:i.PbCl2微溶于水
ii.PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)△H>0
PbCl42-(aq)△H>0
(1)浸取过程中MnO2与PbS发生如下反应,请将离子反应补充完整并配平:_____
______+___Cl-+___PbS+___MnO2=___PbCl2+__SO42-+_____ +_____
(2)由于PbCl2微溶于水,容易附着在方铅矿表面形成“钝化层”使反应速率大大降低,浸取剂中加入饱和NaCl溶液可有效避免这一现象,原因是__________。
(3)调pH的目的是____________。
(4)沉降池中获得PbCl2采取的措施有_________。
(5)通过电解酸性废液可重新获得MnO2,装置示意图如下:
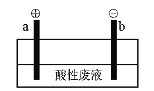
①在_____极(填“a”或“b”)获得MnO2,电极反应为_______________。
②电解过程中发现有Cl2产生,原因可能是_____________(用化学用语表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取、净化并收集氯气涉及以下几个主要阶段:![]()
![]()
![]()
![]() 尾气处理
尾气处理
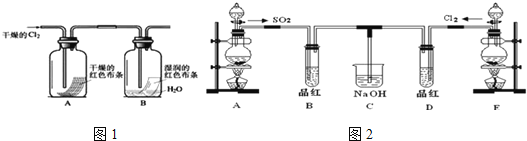
(1)写出实验室制取Cl2的离子方程式______________________,NA表示阿伏加德罗常数,若有4mol的HCl参加反应,则转移的电子总数为___________;
(2)现有以下3种试剂:A.饱和食盐水 B.浓硫酸 C.NaOH溶液
请在以上试剂中选择并回答填空:
X溶液应选用_________(填写序号);Y试剂的作用____________________.
(3)某化学兴趣小组为了探究Cl2的相关性质,设计了如图1的实验.
通入Cl2后,从观察集气瓶A、B中的现象可得出的结论是_____________(写出化学反应方程式,并用简要文字解释).
(4)某兴趣小组的同学为探究和比较SO2和氯水的漂白性,设计了如图2的实验装置.
①实验室用装置A制备SO2.某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:______________________;
②反应开始一段时间后,观察到B、D两试管中的品红溶液都出现褪色的现象,但两者褪色原理不同,如何区别,请你帮助设计实验,你的操作是_________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】高分子纳米活性钛无霸是钛氧化物经过光照射,在其表面产生氧化性极强的活性离子,这种活性离子可以分解存在生活空间中的一些有害物质(甲醛、氮氧化物等)。
(1)Ti2+的基态价电子排布式为_______________________。
(2)甲醛分子中C原子轨道杂化类型为____________。1mol甲醛分子中含有σ键的数目为___________。
(3)甲醛易溶于水,除因为它们都是极性分子外,还因为_______________________。
(4)与N2O互为等电子体的一种分子为________________________(填化学式) 。
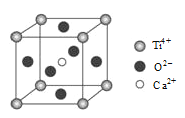
(5)某含钛化合物晶胞结构如图所示,该化合物的化学式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com