
科目: 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度变化如图所示。据图分析,下列判断正确的是( )
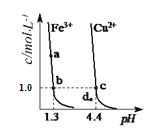
A. Ksp[Cu(OH)2]数量级为10-20
B. d点表示Cu(OH)2形成饱和溶液
C. 加适量NH4Cl固体可使溶液由a点变到b点
D. b、c两点表示Fe(OH)3、Cu(OH)2溶解度相等
查看答案和解析>>
科目: 来源: 题型:
【题目】中科院某课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如图所示),该电池可将可乐(pH=2.5)中的葡萄糖作为燃料获得能量。下列说法中正确的是( )
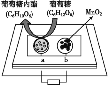
A. a极为正极
B. 随着反应不断进行,负极区的pH不断增大
C. b极电极反应式为MnO2+2H2O+2e-=Mn2++4OH-
D. 消耗0.01mol葡萄糖,电路中转移0.02mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验对应现象及结论有错误的是( )
选项 | 实验 | 现象 | 结论 |
A | 向AgCl悬浊液中加入KI溶液,振荡 | 沉淀由白色变为黄色 | AgCl溶解度大于AgI |
B | 向2mL0.1mol/L的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
C | 常温下,向等体积、等浓度的NaHCO3和CH3COONa溶液中分别滴加2滴酚酞 | 两份溶液均变红,NaHCO3溶液红色更深 | 常温下的水解平衡常数: Kh(CH3COO-)<Kh(HCO3-) |
D | 常温时,用两支试管各取4mL 0.1mol/L 酸性KMnO4溶液,分别加入0.1mol/L和0.2 mol/L H2C2O4溶液各2 mL | 两试管溶液均褪色,且加0.2mol/L H2C2O4 溶液的试管中褪色更快 | 其它条件不变,H2C2O4溶液的浓度越大,化学反应速率越大 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】400 ℃时,将一定量的SO2和14 mol O2压入一个盛有催化剂的10 L密闭容器中进行反应:2SO2+O2![]() 2SO3,已知2 min后,容器中剩余2 mol SO2和12 mol O2。试计算:
2SO3,已知2 min后,容器中剩余2 mol SO2和12 mol O2。试计算:
(1)生成SO3的物质的量__________________。
(2)SO2的起始物质的量浓度____________________。
(3)2 min内SO2和SO3的反应速率______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是
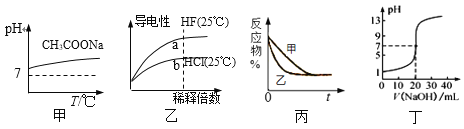
A. 图甲表示升高温度醋酸钠的水解程度增大,溶液碱性增强
B. 图乙表示氢氟酸为弱酸,且a点Kw的数值比b点Kw的数值大
C. 图丙表示压强对可逆反应2A(g) +2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
D. 图丁表示0.100 0 mol·L1 NaOH溶液滴定20.00 mL 0.100 0 mol·L1醋酸溶液的滴定曲线
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 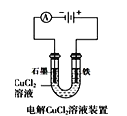 中阳极处能产生使湿润淀粉KI试纸变蓝的气体
中阳极处能产生使湿润淀粉KI试纸变蓝的气体
B. 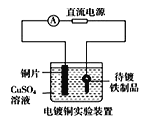 中待镀铁制品应与电源正极相连
中待镀铁制品应与电源正极相连
C. 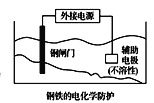 中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法
中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法
D. 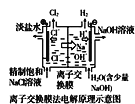 中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述错误的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述错误的是
A.放电时正极附近溶液的碱性增强
B.放电时每转移3mol电子,正极有1molK2FeO4被还原
C.充电时锌极与外电源负极相连
D.充电时阳极反应为Fe(OH)3-3e-+H2OFeO42-+5H+
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年诺贝尔化学奖在10月3日揭晓,弗朗西斯阿诺德、乔治史密斯和格雷戈里温特尔共同获奖,以表彰他们在酶的定向演化以及用于多肽和抗体的噬菌体展示技术方面取得的成果。如图所示是木瓜蛋白酶(蛋白质)的结构简式,下列说法不正确的是( )
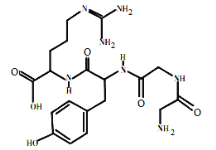
A. 醋酸铅可使木瓜蛋白酶变性
B. 木瓜蛋白酶含有苯环,属于芳香烃
C. 木瓜蛋白酶能发生水解反应、加成反应
D. 木瓜蛋白酶能与碳酸钠反应生成CO2气体
查看答案和解析>>
科目: 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式:
①I2(g)+H2(g)![]() 2HI(g) △H=-9.48kJmol-1
2HI(g) △H=-9.48kJmol-1
②I2(s)+H2(g)![]() 2HI(g)△H=+26.48kJmol-1,下列判断正确的是
2HI(g)△H=+26.48kJmol-1,下列判断正确的是
A.反应①的产物比反应②的产物稳定
B.254g I2(g)中通入2g H2(g),反应放热9.48kJ
C.反应②的反应物总能量比反应①的反应物总能量低
D.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是

A.a点由水电离出的c(H+)=1.0×10-14mol/L
B.b点:c(NH4+)+c(NH3·H2O) >c(Cl-)
C.b点时加入的盐酸体积小于20.00mL,而c点时加入的盐酸体积大于20.00mL
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com