
科目: 来源: 题型:
【题目】亚硝酸钠是一种食品添加剂,具有防腐和抗氧化作用。某同学对亚硝酸钠进行了相关探究。
(一)查阅资料
①亚硝酸钠(NaNO2)为无色、无味的晶体。
②HNO2是一种弱酸,酸性比醋酸略强,性质不稳定,易分解生成NO和NO2;能被常见强氧化剂氧化;但在酸性溶液中它也是一种氧化剂,如能把I-氧化成I2。
③AgNO2是一种微溶于水、易溶于酸的浅黄色固体。
(二)问题讨论
(1)人体正常的血红蛋白中应含Fe2+,误食亚硝酸盐(如NaNO2)会致使机体组织缺氧,出现青紫而中毒,原因是__________________________________________。
若发生中毒时,你认为下列物质有助于解毒的是______(填字母)。
a.鸡蛋清 b.胃舒平 [主要成分是Al(OH)3] c.小苏打 d.维生素C
(2)由于亚硝酸钠和食盐性状相似,曾多次发生过将NaNO2误当食盐食用的事件。要区别NaNO2和NaCl两种固体,你需用的试剂是_____________________________。
(三)实验测定
为了测定某样品中NaNO2的含量,某同学进行如下实验:①称取样品a g,加水溶解,配制成100 mL溶液。②取25.00 mL溶液于锥形瓶中,用0.0200mol·L-1 KMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液 V mL。
(3)上述实验①所需玻璃仪器除玻璃棒、胶头滴管之外还有________________。
(4)在进行滴定操作时,KMnO4溶液盛装在________(填“酸式”或“碱式”)滴定管中。当滴入最后一滴溶液,____________________________________________________时达到滴定终点。
(5)滴定过程中发生反应的离子方程式是_________________________________;测得该样品中NaNO2的质量分数为________。
(6)若滴定过程中刚出现颜色变化就停止滴定,则测定结果________。(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】低碳经济是指在可持续发展理念指导下,尽可能地减少煤炭、石油等高碳能源消耗,减少温室气体排放,达到经济社会发展与生态环境保护双赢的一种经济发展形态。下列是有关碳元素的相关转化,回答下列问题:
(1)已知甲醇是一种清洁燃料,制备甲醇是煤液化的重要方向。若已知H2(g)、CO(g)、CH3OH(l)的燃烧热分别为H=-285.8kJ/mol、△H=-283.0kJ/mol、△H=-726.5kJ/mol,CO(g)+2H2(g)![]() CH3OH(l) △H=________ kJ/mol。
CH3OH(l) △H=________ kJ/mol。
(2)一定温度下,一定可以提高甲醇合成速率的措施有(______)
a.增大起始通入![]() 值
值
b.恒温恒容,再通入氦气
c.使用新型的高效正催化剂
d.将产生的甲醇及时移走
e.压缩体积,増大压强
(3)在恒温恒容条件下,下列说法可以判定反应CO(g)+2H2(g) ![]() CH3OH(g)已经达到平衡状态的是(______)
CH3OH(g)已经达到平衡状态的是(______)
a.体系中碳氢单键数目不再改变
b.体系中n(CO):n(H2)不再改变
c.体系中压强或者平均摩尔质量不再改变
d.单位时间内消耗氢气和CH3OH的物质的量相等
(4)在恒压的容器中,曲线X、Y、Z分别表示在T1°C、T2°C和T3°C三种温度下合成甲醇气体的过程。控制不同的原料投料比,CO的平衝转化率如图所示:
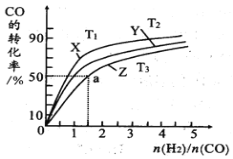
①温度T1°C、T2°C和T3°C由高到低的順序为:_________________;
②若温度为T3°C时,体系压强保持50aMPa,起始反应物投料比n(H2)/n(CO)=1.5,则平衡时CO和CH3OH的分压之比为__________,该反应的压强平衡常数Kp的计算式为__________。(Kp生成物分压幂的乘积与反应物分压幂的乘积的比值,某物质的分压等于总压强×该物质的物质的量分数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼及其化合物在工农业生产中具有广泛应用。
请回答下列问题:
(1)基态B原子的价电子排布图___,B属于元素周期表中的___区元素。
(2)NaBO2可用于织物漂白。
①第二周期中第一电离能介于B和O之间的元素为___(填元素符号)。
②BO2-的空间构型为____,写出两种与其互为等电子体的分子的化学式:____。
(3)BF3和F-可以形成BF4-,BF3和BF4-中B原子的杂化方式分别为_____、____。
(4)立方BN和立方AlN均为原子晶体,结构相似,BN的熔点高于AlN的原因为______。
(5)一种新型轻质储氢材料的晶胞结构如图所示:
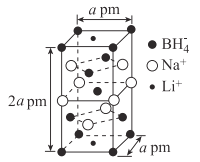
①该化合物的化学式为____。
②设阿伏加德罗常数的值为NA,该晶体的密度为___g·cm-3(用含a、NA的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态电子排布式可表示为________。
(2)MX3-的空间构型是________(用文字描述)。H2X分子的VSEPR模型名称为________。
(3)含Z(H2X)42+的溶液中通入MH3,会生成Z(MH3)42+的原因___________________________。(从电负性角度解释)
(4) 1 mol WX2中含有的π键数目为________。
(5) AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃ ,其晶胞结构如图所示。
①磷化铝的晶体类型为_____________。
②A、B点的原子坐标如图所示,则C点的原子坐标为_______。
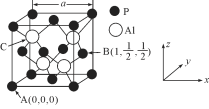
③磷化铝的晶胞参数a=546.35pm(1pm=10-12m),其密度为____________ g/cm3(列出计算式即可,用NA表示阿伏加德罗常数的数值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。(请用相应的化学用语答题)
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1)R的元素符号为________;M在元素周期表中的位置为________________。
(2)X与Y按原子个数比1∶1构成的物质的电子式为________________;所含化学键类型__________________________。
(3)X+、Y2-、M2-离子半径大小顺序为__________________。
(4)将YM2通入FeCl3溶液中的离子方程式:_________________________________________。
Ⅱ.如图转化关系(A、B、C中含相同元素)
![]()
![]()
![]()
![]()
![]()
(1)若B为白色胶状不溶物,则A与C反应的离子方程式为_________________________。
(2)若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应生成B的离子方程式为_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学兴趣小组设计“乙醇催化氧化实验”来探究催化剂的催化机理并对反应后的产物进行分析,装置(夹持装置等已省略)如图所示。试回答以下问题:
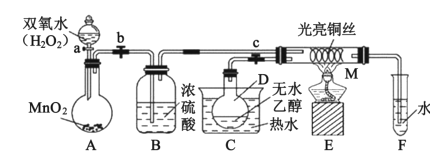
(1)C中热水的作用是___;在装入实验药品之前,应进行的操作是___。
(2)装入实验药品后,关闭活塞a、b、c,在铜丝的中间部分加热片刻,M处铜丝由红变黑,反应的化学方程式为___,然后打开活塞a、b、c,通过控制活塞a和b,间歇性地通入气体,即可在M处观察到受热部分的铜丝交替出现变红、变黑的现象。铜丝由黑变红时,发生反应的化学方程式为___。通过实验,可以得出结论:该实验过程中催化剂___(填“参加”或“不参加”)化学反应。
(3)反应进行一段时间后,试管F中能收集到的有机物主要有___、___。
(4)若试管F中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还有___。要除去该物质,可先在混合液中加入___(填字母),然后通过___即可(填操作名称)。
A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,已知某三元弱酸H3A的三级电离平衡常数分别为![]() 、
、![]() 、
、![]() ,下列说法错误的是
,下列说法错误的是
A.Na3A的第一级水解平衡常数Kh1的数量级为10-2
B.在NaH2A溶液中:![]()
C.0.1mol/L的Na3A和0.1mol/L的Na2HA溶液中水电离程度,前者大于后者
D.向H3A溶液中加入NaOH溶液至中性时:c(Na+)=3c(A3-)+2c(HA2-)+c(H2A-)
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol·L-1 CuCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是(已知:lg 2=0.3,Ksp(ZnS)=3×10-25)
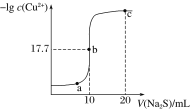
A.a、b、c三点中,水的电离程度最大的为b点
B.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C.该温度下Ksp(CuS)=4×10-36
D.向100 mL Zn2+、Cu2+浓度均为10-5mol·L-1的混合溶液中逐滴加入10-4 mol·L-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】化学兴趣小组设计如图所示的装置来验证元素非金属性的强弱:
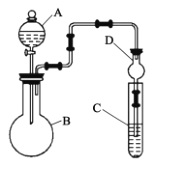
(1)仪器B的名称为___,干燥管D的作用是___。
(2)甲组同学的实验目的:证明非金属性:Cl>I。C中为淀粉—碘化钾混合溶液,B中装有KMnO4固体,则A中试剂为___,观察到C中溶液___(填现象),即可证明。但乙组同学认为该装置有明显的缺陷,改进方案是___。
(3)丙组同学的实验目的:证明非金属性:S>C>Si。在A中加稀硫酸、B中加Na2CO3溶液、C中加Na2SiO3溶液。观察到___(填现象),即可证明。C中发生反应的化学方程式为___。
(4)丁组同学的实验目的:证明非金属性:N>C>Si。实验方案与丙组同学的相似。在A中加稀硝酸、B中加Na2CO3溶液、C中加Na2SiO3溶液。观察到与丙组同学相同的实验现象,即可证明。但丙组同学认为该方案能证明非金属性:N>C,但不能证明非金属性:C>Si,理由是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )

A. H2A为二元弱酸,稀释前c(H2A)=0.005mol/L
B. NaHA水溶液中:c(Na+)+ c(H+)= 2c(A2-)+ c(OH-)
C. 含等物质的量的NaHA、NaHB的混合溶液中:c(Na+)= c(A2-)+ c(B2-)+ c(HB-)+ c(H2B)
D. pH=10的NaHB溶液中,离子浓度大小为:c(Na+)>c(HB-)>c(OH-)>c(B2-)>c(H2B)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com