
科目: 来源: 题型:
【题目】下列实验误差分析错误的是
A. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
B. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
C. 用润湿的pH试纸测稀碱溶液的pH,测定值偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目: 来源: 题型:
【题目】美托洛尔可用于治疗高血压及心绞痛,某合成路线如下:
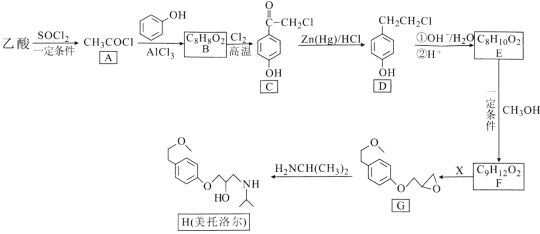
回答下列问题:
(1)美托洛尔分子中含氧官能团的名称是_____。
(2)A→B的反应类型是____,G的分子式为____。
(3)反应E→F的化学方程式为_______。
(4)试剂X的分子式为C3H5OCl,则X的结构简式为____。
(5)B的同分异构体中,含有苯环且能发生水解反应的共有____种,其中苯环上只有一个取代基且能发生银镜反应的结构简式为_____。
(6)4-苄基苯酚(![]() )是一种药物中间体,请设计以苯甲酸和苯酚为原料制备4-苄基苯酚的合成路线:__________(无机试剂任用)。
)是一种药物中间体,请设计以苯甲酸和苯酚为原料制备4-苄基苯酚的合成路线:__________(无机试剂任用)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学符号表征正确的是
A. 电解法精炼铜,阴极电极反应:Cu2++2e-== Cu
B. H2S在水溶液中的电离:H2S![]() 2H++ S2-
2H++ S2-
C. 甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4 (g)+2O2 (g) ==CO2 (g)+2H2O (g) ΔH=-890.3 kJ·mol-1
D. 碳酸钠水解的离子方程式:CO32-+2H2O![]() 2OH-+H2CO3
2OH-+H2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列物质:① N2 ②Na2O2 ③NaOH ④HCl ⑤H2O2 ⑥MgF2 ⑦NH4Cl。
(1)只由非极性键构成的物质是__________________(填编号)。
(2)由离子键和极性键构成的物质是_______________。
(3)⑤H2O2的电子式为:_________________。
(4)用电子式表示⑥MgF2的形成过程:______________。
(5)下列说法不正确的是________。
①共价化合物中含共价键,也可能含离子键
②因为H2CO3酸性<H2SO3酸性,所以非金属性C<S
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤熔融状态能导电的物质是离子化合物
⑥由分子组成的化合物中一定存在共价键
A. ①③⑤ B. ①②⑥ C. ①②④⑤ D. ①③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1)铁原子核外电子发生跃迁时会吸收或释放不同的光,可以用___摄取铁元素的原子光谱。
(2)FeC13的熔点为306℃,沸点为315℃。由此可知FeC13属于____晶体。FeSO4常作净水剂和补铁剂,SO42-的立体构型是____。
(3)铁氰化钾 K3[Fe(CN)6]是检验Fe2+的重要试剂。
①基态N原子的轨道表示式为____。
②写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式_____。
③铁氰化钾中,所涉及的元素的第一电离能由大到小的顺序为____。
④铁氰化钾中,不存在___(填字母标号)。
A.离子键 B.σ键 C.π键 D.氢键 E.金属键
(4)有机金属配位化合物二茂铁[(C5H5)2Fe]是汽油中的抗震剂。分子中的大Π键可用符号![]() 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为![]() ),则
),则![]() 中的大Π键应表示为____,其中碳原子的杂化方式为____。
中的大Π键应表示为____,其中碳原子的杂化方式为____。
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含__mol配位键。
(6)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。其中铁原子周围最近的铁原子个数为___;六棱柱底边长为acm,高为c cm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为____g/cm3(列出计算式)。

查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品,将SO2通入Na2CO3和Na2S混合溶液中可制得Na2S2O3。其制备装置如图所示。

(1)A中反应的化学方程式为_____。
(2)为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为____。
(3)为了保证硫代硫酸钠的产量,实验中通人的SO2不能过量,原因是___。
(4)待Na2S和Na2CO3完全消耗后,结束反应。过滤B中的混合物,滤液经过__、___(填操作名称)、过滤、洗涤、干燥,得到Na2S2O35H2O晶体。
(5)称取10.0g产品(Na2S2O35H2O,相对分子质量为248),配成250mL溶液,取25.00mL溶液,以淀粉作指示剂,用 0.1000 mol/L碘的标准溶液滴定。(反应原理为:2S2O32-+I2 = S4O62-+2I-,忽略Na2SO3与I2反应)。
①滴定终点的现象为____。
②重复三次的实验数据如表所示,其中第三次读数时滴定管中起始和终点的液面位置如图所示,则x=____,产品的纯度为__。


查看答案和解析>>
科目: 来源: 题型:
【题目】将15.2 g 铜和镁组成的混合物加入250 mL4.0molL-1的稀硝酸中,固体完全溶解,生成的气体只有NO。向所得溶液中加入1.0L NaOH溶液,此时金属离子恰好沉淀完全,沉淀质量为25.4 g,下列说法正确的是
A.原固体混合物中,Cu和Mg的物质的量之比为1:2
B.氢氧化钠溶液的浓度为0.8 mol·L-1
C.固体溶解后的溶液中硝酸的物质的量为0.1mol
D.生成的NO气体在标况下的体积为2.24 L
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下将pH=8的NaOH溶液稀释1000倍,稀释后溶液中c(Na+)与c(OH-)之比接近
A. 1:1 B. 1:102 C. 102:1 D. 1:103
查看答案和解析>>
科目: 来源: 题型:
【题目】用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )

A. 上下移动①中铜丝可控制SO2的量
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目: 来源: 题型:
【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)反应Ⅰ:Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1 平衡常数为K1
FeO(s)+CO(g) ΔH1 平衡常数为K1
反应Ⅱ:Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH1 平衡常数为K2
FeO(s)+H2(g) ΔH1 平衡常数为K2
不同温度下,K1、K2的值如下表:

现有反应Ⅲ:H2(g)+CO2(g)![]() CO(g)+H2O(g),结合上表数据,反应Ⅲ是___(填“放热”或“吸热”)反应,为提高CO2的转化率可采用措施有___(写出任意两条)。
CO(g)+H2O(g),结合上表数据,反应Ⅲ是___(填“放热”或“吸热”)反应,为提高CO2的转化率可采用措施有___(写出任意两条)。
(2)已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) H<0。设m为起始时的投料比,即m= n(H2)/ n(CO2)。
C2H5OH(g)+3H2O(g) H<0。设m为起始时的投料比,即m= n(H2)/ n(CO2)。

①图1中投料比相同,温度从高到低的顺序为______。
②图2中m1、m2、m3从大到小的顺序为____。
③图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质化学名称为____,T4温度时,该反应平衡常数KP的计算式为____。
(3)工业上常用高浓度的 K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图:

①在阳极区发生的反应包括____和H++HCO3- ==CO2↑+H2O
②简述CO32-在阴极区再生的原理:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com