
科目: 来源: 题型:
【题目】炼铁厂的废渣铁矾渣主要含有K2Fe6(SO4)4(OH)12 、ZnO![]() Fe2O3 及少量的CaO、MgO、SiO2 ,等等。可利用废渣铁矾渣制备复合镍锌铁氧体 (NiZnFe4O8.具体制备流程如下图所示:
Fe2O3 及少量的CaO、MgO、SiO2 ,等等。可利用废渣铁矾渣制备复合镍锌铁氧体 (NiZnFe4O8.具体制备流程如下图所示:

(1)试剂1是过量的______。
(2)试剂2为过量的铁粉,加入后可以观察的现象有 ______________________。
(3)NH4F溶液不能放入玻璃器皿中保存,理由是_____________________________(用离子方程式表示)。已知:25 °C时,Ksp(CaF2)=2.7×10-11、,Ksp(MgF2)=6.4×10-19。加入NH4F溶液沉淀后,c(Mg2+) = 1. 6×10-10mol L-1,此时Ca2+是否也完全沉淀?写出具体的分析过程:______(若溶液中某离子浓度小于1.0×10-5mol L-1时,说明该离子已沉淀完全)。
(4)在Fe2+、Ni2+、Zn2+共沉淀过程中,若以Me代表Fe、Ni、Zn元素,则生成MeCO32Me(OH)2H2O沉淀的化学方程式为 ________________________________.
(5)按照上述流程,一座10万吨规模的炼铁厂每年产生铁矶渣约5万吨,Fe3+含量为44.8%,理论上每年至少可制备复合镍锌铁氧体(NiZnFe4O8 ,M=476 g mol -1 )__________万吨。
(6)滤液Ⅱ中加入的ZnSO4溶液,低温烘干后可得到皓矾(ZnSO4 7H2O) 取28.70 g皓矾加热至不同温度,剩余固体的质量变化如图所示:

①100 °C时所得固体的化学式__________ 。
②680 °C时所得固休的化学式为____
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ/mol。下列热化学方程式书写正确的是( )
A. 2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ΔH=-57.3kJ/mol
B. KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol
K2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol
C. C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(g) ΔH=-5518kJ/mol
O2(g)=8CO2(g)+9H2O(g) ΔH=-5518kJ/mol
D. 2C8H18(g)+25O2(g)=16CO2(g)+18H2O(1) ΔH=-5518kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年北京市公交行业迈入氢能源时代。“制氢”“储氢”“用氢”等一直都是能源研究的热点。工业上制取H2有多种方法.如:
①C(s)+H2O(g)=CO(g)+H2(g) △H1=+131.5kJ·mol-1
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2=+206.2kJ·mol-1
③CH4(g)+CO2(g)=2CO(g)+2H2(g) △H3=+247.4kJ·mol-1
④2H2O(g)=2H2(g)+O2(g) △H4=+483.6kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:____________________ .
(2)氢气燃料电池能大幅度提高能量的转化率。相同条件下,其能量密度(能量密度之比等于单位质量的可燃物转移电子数之比)是甲醇燃料电池的_______倍(计算结果保留两位有效数字)。
(3)科学家研发的“全氢电池"的工作原理如图所示,该电池工作一段时间后,右池溶液的导电 能力几乎不变。下列有关该电 池的说法正确的是 _____(填字母代号)。

a.电池的总反应是2H2 +O2 = 2H2O
b.左边电极上的电势高于右边电极上的电势
c.负极的电极反应是H2 - 2e- + 2OH- = 2H2O
d.装置中所用的是阴离子交换膜
e.产生能源的源泉是酸和碱的中和能
(4)LiFePO4电池稳定性高、安全、对环境友好,该电池的总反应式是Li1-xFePO4+LixC6![]() LiFePO4+C6,其放电时的工作原理如图所示。则:充电时,电极a的电极名称为_______________ ; 放电时电极b的电极反应式为______________________________ .
LiFePO4+C6,其放电时的工作原理如图所示。则:充电时,电极a的电极名称为_______________ ; 放电时电极b的电极反应式为______________________________ .

查看答案和解析>>
科目: 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题。
下列物质组别中①互为同位素的是___(填组别选项,下同);②互为同素异形体的是___;③互为同分异构体的是___;④属于同一物质的是___;⑤属于同系物的是___。
A.冰与水B.H2、D2、T2C.O2与O3D.![]() K与
K与![]() KE.CH3—CH2—CH2—CH3与
KE.CH3—CH2—CH2—CH3与 F.
F. 与
与 G.甲烷和庚烷
G.甲烷和庚烷
查看答案和解析>>
科目: 来源: 题型:
【题目】原子序数小于36的X、Y、Z、R、W五种元素,其中X是周期表中原子半径最小的元素,Y是形成化合物种类最多的元素,Z原子基态时2p原子轨道上有3个未成对的电子,R单质占空气体积的![]() ;W的原子序数为29。回答下列问题:
;W的原子序数为29。回答下列问题:
(1)Y2X4分子中Y原子轨道的杂化类型为________,1mol Z2X4含有σ键的数目为 ________。
(2)化合物ZX3与化合物X2R的VSEPR构型相同,但立体构型不同,ZX3的立体构型为 ________,两种化合物分子中化学键的键角较小的是________(用分子式表示,下同)。
(3)与R同主族的三种非金属元素与X可形成结构相似的三种物质,试推测三者的稳定性由大到小的顺序________,理由是 ________;三者的沸点由高到低的顺序是 ________,解释原因________。
(4)元素Y的一种氧化物与元素Z的单质互为等电子体,元素Y的这种氧化物的分子式是________。
(5)W元素有________个运动状态不同的电子,其基态原子的价电子排布式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)Ba(OH)2·8H2O固体与NH4Cl固体反应的化学方程式为_____________。
(2)拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。理论上,每生成1 mol NH3___________热量(填“吸收”或“放出”)__________kJ;事实上,反应的热量总小于理论值,为什么?________________。
(3)一定条件下发生反应:6NO(g) + 4NH3(g)![]() 5N2(g) + 6H2O(g),某次实验中测得容器内NO及N2的物质的量随时间变化如下图甲所示,图中b点对应的速率关系是v(正) _____ v(逆) ; d点对应的速率关系是v(正) ___________ v(逆)。(填“﹥”、“﹤”或“﹦”)
5N2(g) + 6H2O(g),某次实验中测得容器内NO及N2的物质的量随时间变化如下图甲所示,图中b点对应的速率关系是v(正) _____ v(逆) ; d点对应的速率关系是v(正) ___________ v(逆)。(填“﹥”、“﹤”或“﹦”)

(4)已知N2(g)+ 3H2(g) ![]() 2NH3(g),若反应起始时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3达到平衡时浓度的范围为_______;若平衡时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3起始时浓度的范围为______。
2NH3(g),若反应起始时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3达到平衡时浓度的范围为_______;若平衡时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3起始时浓度的范围为______。
(5)已知一定条件下发生:2SO2(g) + O2(g) ![]() 2SO3(g) (正反应放热),在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)
2SO3(g) (正反应放热),在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)

t1________________________;t2________________________;
t3________________________;t4________________________。
(6)①某电池采用锂和石墨作电极,四氯化铝锂(LiAlCl4)溶解在亚硫酰氯中(SOCl2)组成电解质溶液,电池总反应为:8Li+3SOCl2=6LiCl+Li2SO3+2S,此电池中_______作正极,负极的电极反应为_________________。
②甲烷燃料电池示意图如上图乙,其负极反应方程式为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯氧磷((POCl3)可用于制备增塑剂,常温下为无色透明液体,易挥发,易水解。一中化学兴趣小组探究制备POCl3所需的装置如下图所示:

反应原理:PCl3+Cl2+H2O![]() POCl3+2HCl(PC13常温下为液态,易挥发)。
POCl3+2HCl(PC13常温下为液态,易挥发)。
(1)仪器3的名称是 _________,仪器2中装入的物质为______,仪器I的作用是_____.
(2)请选择上述必要装置并组装,用小写字母连接:________________________。
(3)开始通入氯气。同时慢慢滴加水,控制氯气和水的质量比在3.94左右,理由是:________________________.
(4)上述装置有一处不足,请指岀该不足:__________________________.
(5)上述反应剩余PCl3可以继续通入Cl2,再和P4O10反应,也可以产生的POC13 .。 写出该反应的化学方程式:__________________________________ .
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,X比Y的原子系数小1,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A.Y原子能形成四核18电子的电中性分子
B.元素非金属性的顺序为X>Y>Z
C.W的单质与氧气反应不能产生含共价键的化合物
D.该新化合物中Y不满足最外层8电子稳定结构
查看答案和解析>>
科目: 来源: 题型:
【题目】能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是______(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。
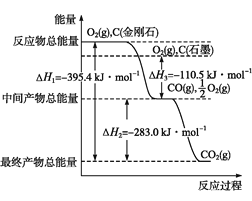
由上图可知,在通常状况下,金刚石和石墨中___(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为__kJ·mol1
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol1、497 kJ·mol1,N2(g)+O2(g)=2NO(g) ΔH=180.0 kJ·mol1。NO分子中化学键的键能为_____kJ·mol1。
(4)综合上述有关信息,请写出CO和NO反应的热化学方程式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com