
科目: 来源: 题型:
【题目】硫、锌及其化合物用途非常广泛。回答下列问题:
(1)O和S处于同一主族。H2O及H2S中,中心原子的杂化方式相同,键长及键角如图所示。
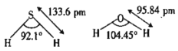
①H2O分子中的键长比H2S中的键长短,其原因是________。
②H2O分子中的键角∠HOH比H2S分子中的键角∠HSH大,其原因是________。
(2)单质硫与热的NaOH浓溶液反应的产物之一为Na2S3。S32-的空间构型为______,中心原子的杂化方式为_______。
(3)噻吩(![]() )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中含有______个σ键。
②分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则噻吩分子中的大π键应表示为________。
),则噻吩分子中的大π键应表示为________。
③噻吩的沸点为84℃,吡咯(![]() )的沸点在129~131℃之间,后者沸点较高,其原因是_________。
)的沸点在129~131℃之间,后者沸点较高,其原因是_________。
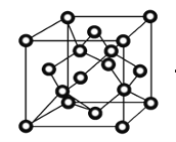
(4)冰晶体的结构与金刚石的结构相似,属立方晶系。如图,将金刚石晶胞中的C原子全部置换成O原子,O原子与最近距离的四个O原子相连,H原子插入两个相连的O原子之间,与氧形成一个共价键和一个氢键,即为冰中的共价键和氢键。0℃时冰晶体中氢键的键长(定义氢键的键长为O—H…O的长度)为_____cm(列出计算式即可)。(0℃时冰密度为0.9g/cm3。)
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素D在周期表中的位置__________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)______。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有________________________________________________________________________。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:________________________________________________________________________。
若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_______________________________________________________________。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式______________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、碱、盐溶液均不反应。已知乙二酸晶体加热分解的方程式为:H2C2O4·2H2O![]() 3H2O+CO2↑+CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。酒精喷灯可作高温热源。请回答下列问题:
3H2O+CO2↑+CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。酒精喷灯可作高温热源。请回答下列问题:
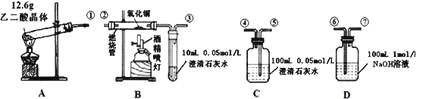
(1)检验装置A气密性的方法是
(2)按气流方向连接各仪器,用数字表示接口的连接顺序:
①→
(3)证明CO存在的实验现象是
(4)本实验尾气处理的方法是
(5)根据题给的数据,假设各反应均充分发生且产生的气体全部排出,并与吸收液充分反应(提示:B、C中澄清石灰水均先变浑浊,后又变澄清),D中溶质及对应的物质的量是: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)比较下列粒子的半径大小
①Na Mg O F __________
②Na+ Mg2+ O2- F-__________
③Fe Fe2+ Fe3+__________
④Na+ Mg2+ S2- Cl-__________
(2)下列物质中:只存在共价键的是__________(填序号,下同),只存在离子键的是__________,既存在离子键又存在极性共价键的是__________,既存在离子键又存在非极性共价键的是__________。
①Ar ②CO2 ③Na2O2 ④KOH ⑤MgBr2 ⑥NH4Cl ⑦CaO ⑧H2SO4
(3)氢气可由天然气和水反应制备,其主要反应为:CH4(g)+ 2H2O(g) ===CO2(g)+4H2(g) 反应过程中能量变化如图所示,则该反应为__________反应(填“吸热”或“放热”)。若已知,破坏1mol化学键需要吸收的热量如代数式表示:
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | a | b | c | d |

则根据该反应制取1mol H2要吸收或放出热量为___________kJ(用含a、b、c、d字母表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入3mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60 mLB.75 mLC.80 mLD.100 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且A原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满。回答下列问题:
(1)B、C中第一电离能较大的是__ (用元素符号填空),基态E原子价电子的轨道表达式______。
(2)DA2分子的VSEPR模型是_____。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
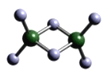
①C2Cl6属于_______晶体(填晶体类型),其中C原子的杂化轨道类型为________杂化。
②[C(OH)4]-中存在的化学键有________。
a.离子键 b.共价键 c.σ键 d.π键 e.配位键 f.氢键
(4)B、C的氟化物晶格能分别是2957 kJ/mol 、5492 kJ/mol,二者相差很大的原因________。
(5)D与E形成化合物晶体的晶胞如下图所示:
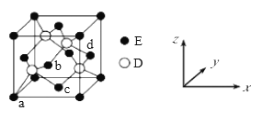
①在该晶胞中,E的配位数为_________。
②原子坐标参数可表示晶胞内部各原子的相对位置。上图晶胞中,原子的坐标参数为:a(0,0,0);b(![]() ,0,
,0,![]() );c(
);c(![]() ,
,![]() ,0)。则d原子的坐标参数为______。
,0)。则d原子的坐标参数为______。
③已知该晶胞的边长为x cm,则该晶胞的密度为ρ=_______g/cm3(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】第VIII族元素单质及其化合物在工业生产和科研领域有重要的用途。
(1)过渡元素Co 基态原子价电子排布式为_____。第四电离能I4 (Co) < I4 (Fe) ,其原因是_________。
(2)Ni(CO)4 常用作制备高纯镍粉,其熔点为-19.3 ℃, 沸点为 43 ℃。则:
①Ni(CO)4的熔、沸点较低的原因为__________。
②写出一种与CO互为等电子体的分子的化学式__________。
③Ni(CO)4中σ键和π键的数目之比为__________。
(3)NiSO4 常用于电镀工业,其中 SO42-的中心原子的杂化轨道类型为_______,该离子中杂化轨道的作用是__________。
(4)氧化镍和氯化钠的晶体结构相同,可看成镍离子替换钠离子,氧离子替换氯离子。 则:
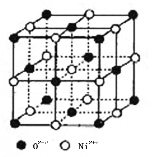
① 镍离子的配位数为__________。
② 若阿伏加德罗常数的值为NA,晶体密度为 ρ g·cm-3,则该晶胞中最近的 O2-之间的距离为__________pm(列出表达式)。
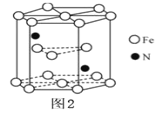
(5)某种磁性氮化铁的结构如图所示,Fe为__________堆积,则该化合物的化学式为__________。 其中铁原子最近的铁原子的个数为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳族元素的单质和化合物在化工、医药、材料等领域有着广泛的应用。
(1)锗是重要半导体材料,基态Ge原子中,核外电子占据最高能级的符号是______,该能级的电子云轮廓图为________。Ge的晶胞结构与金刚石类似,质地硬而脆,沸点2830℃,锗晶体属于_______晶体。
(2)(CH3)3C+是有机合成重要中间体,该中间体中碳原子杂化方式为_______,(CH3)3C+中碳骨架的几何构型为________。
(3)治疗铅中毒可滴注依地酸钠钙,使Pb2+转化为依地酸铅盐。下列说法正确的是_______。
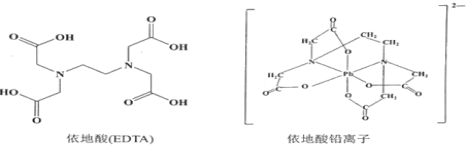
A.形成依地酸铅离子所需n(Pb2+)∶n(EDTA)=1∶4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
D.依地酸具有良好的水溶性是由于其分子间能形成氢键
(4)下表列出了碱土金属碳酸盐的热分解温度和阳离子半径:
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
碱土金属碳酸盐同主族由上到下的热分解温度逐渐升高,原因是:__________。
(5)有机卤化铅晶体具有独特的光电性能,下图为其晶胞结构示意图:
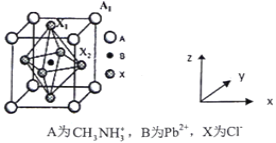
①若该晶胞的边长为anm,则Cl-间的最短距离是________。
②在该晶胞的另一种表达方式中,若图中Pb2+处于顶点位置,则Cl-处于____位置。
查看答案和解析>>
科目: 来源: 题型:
【题目】钛由于其稳定的化学性质,良好的耐高温、耐低温、抗强酸、抗强碱以及高强度、低密度,被美誉为“未来钢铁”、“战略金属”。
(1)基态钛原子核外共有_______种运动状态不相同的电子,价电子排布式_______;与钛同周期的元素中,基态原子的未成对电子数与钛相同的有________种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是_________。
(3)TiCl4是氧化法制取钛的中间产物。TiCl4分子结构与CCl4相同,在常温下都是液体。TiCl4分子的空间构型是_______;TiCl4稳定性比CCl4差,试从结构分析其原因:_______。
(4)钙钛矿材料是一类有着与钛酸钙相同晶体结构的材料,这种奇特的晶体结构让它具备了很多独特的理化性质,比如吸光性、电催化性等。钛酸钙晶体结构如图所示。其中,A代表Ca2+,Ti原子位于由O原子构成的正八面体的中心,则钛酸钙的化学式为______,Ca2+的配位数是________。

查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,HA的电离常数Ka=1×10-6,向20 mL浓度为0.01 mol·L-1的HA溶液中逐滴加入0.01mol·L-1的NaOH溶液,溶液的pH与加入NaOH溶液的体积之间的关系如图所示,下列说法正确的是( )

A.a点对应溶液的pH约为4,且溶液中只存在HA的电离平衡
B.b点对应溶液中:c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-)
C.d点对应溶液中:c(OH-)-c(H+)=c(A-)
D.a、b、c、d四点对应的溶液中水的电离程度:a<b<c<d
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com