
科目: 来源: 题型:
【题目】据报道,近年来发现了一种新的星际分子,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键、三键等,颜色相同的球表示同一种原子)。
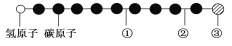
下列对该物质的说法中正确的是
A. ①处的化学键表示碳碳双键 B. ②处的化学键表示碳碳单键
C. ③处的原子可能是氯原子或氟原子 D. 此星际分子属于烃类
查看答案和解析>>
科目: 来源: 题型:
【题目】KMnO4是中学常见的强氧化剂,用固体碱熔氧化法制备KMnO4的流程和反应原理如图:

反应原理:
反应I:3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
反应Ⅱ:3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3
(墨绿色) (紫红色)
已知25℃物质的溶解度g/100g水
K2CO3 | KHCO3 | KMnO4 |
111 | 33.7 | 6.34 |
请回答:
(1)下列操作或描述正确的是___
A.反应Ⅰ在瓷坩埚中进行,并用玻璃棒搅拌
B.步骤⑥中可用HCl气体代替CO2气体
C.可用玻璃棒沾取溶液于滤纸上,若滤纸上只有紫红色而无绿色痕迹,则反应Ⅱ完全
D.步骤⑦中蒸发浓缩至溶液表面有晶膜出现再冷却结晶:烘干时温度不能过高
(2)___(填“能”或“不能”)通入过量CO2气体,理由是___(用化学方程式和简要文字说明)。
(3)步骤⑦中应用玻璃纤维代替滤纸进行抽滤操作,理由是___。
草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ.称取1.6000g高锰酸钾产品,配成100mL溶液
Ⅱ.准确称取三份0.5025g已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化;
Ⅲ.锥形瓶中溶液加热到75~80℃,趁热用I中配制的高锰酸钾溶液滴定至终点。
记录实验数据如表
实验次数 | 滴定前读数/mL | 滴定后读数/mL |
1 | 2.65 | 22.67 |
2 | 2.60 | 23.00 |
3 | 2.58 | 22.56 |
已知:MnO4﹣+C2O42﹣+H+→Mn2++CO2↑+H2O(未配平)
则KMnO4的纯度为___(保留四位有效数字);若滴定后俯视读数,结果将___(填“偏高”或“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法和解释错误的是
A. 冰融化时,需破坏晶体中的全部氢键,所以冰融化时密度变大
B. 卤化物![]() 从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
C. 由于石墨晶体中层间距较远,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向
D. 金属中的“电子气”在电场中可以定向移动,所以金属具有良好的导电性。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有机反应的化学方程式书写正确是
A.CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B.2![]() +Br2
+Br2![]() 2
2![]()
C.2CH3CH2OH+O2![]() 2 CH3CHO+2H2O
2 CH3CHO+2H2O
D.CH3CH2OH+CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是海带中提取碘的流程图:
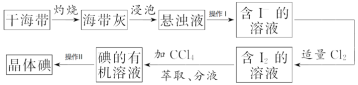
回答下列问题。
(1)干海带在_____________________中灼烧(填仪器名称)
(2)操作I名称为_____________________
(3)分液漏斗在使用前须清洗干净并_____________________,在本实验分离过程中,碘的四氯化碳应该从分液漏斗的_____________________(填“上口倒出”或“下口放出”)
(4)操作II名称为_____________________,该操作中加入碎瓷片的作用是_____________________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_____________________(填标号)。
A.立即补加B.冷却后补加C.不需补加D.重新配料
(5)在操作II中,仪器选择及安装都最合理的是_____________________(填标号)。

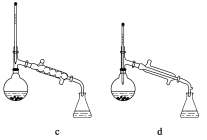
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的五种短周期元素,其中C为第三周期简单离子半径最小的元素,0.1mol·L1A、B、D的最高价氧化物对应的水化物溶液加水稀释时溶液的pH变化情况如图,则下列说法中不正确的是
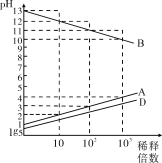
A. C制的容器可盛装A和D的最高价含氧酸的浓溶液
B. AE3、D2E2分子中所有原子最外层均达到8电子结构
C. B、D、E的单质或者化合物中都可能有能作漂白剂的物质
D. 工业上分别电解熔融的B与E、C与E形成的化合物制备B、C单质
查看答案和解析>>
科目: 来源: 题型:
【题目】沙丁胺醇是一种新型药物,常用于缓解哮喘等肺部疾病,其一种合成路线如图: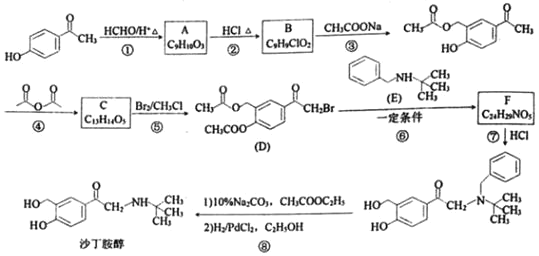
已知:RX+![]() →
→![]() +HX
+HX
请回答:
(1)化合物C的结构简式为___。
(2)反应⑦的化学方程式为___。
(3)下列说法不正确的是___。
A.化合物A能与FeCl3溶液发生显色反应
B.化合物B能发生消去反应
C.1 mol 化合物D最多能与3mol NaOH反应
D.沙丁胺醇的分子式为C13H19NO3
(4)写出同时符合下列条件的化合物E的所有同分异构体的结构简式___。
①IR谱表明分子中含有﹣NH2,且与苯环直接相连;
②1H﹣NMR谱显示分子中有五种不同化学环境的氢原子,且苯环上只有一种氢原子。
(5)请设计以甲苯和异丁烯[CH2=C(CH3)2]为原料合成化合物E的合成路线___(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。
(一)CO2的化学捕获:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为___(写含碳粒子符号)。(室温下,H2CO3的Ka1=4.3×10﹣7;Ka2=5.6×10﹣11)
(2)固体氧化物电解池(SOEC)用于高温共电解CO/H2,既可实现CO2的减排又可高效制备合成气(CO/H2),其工作原理如图。写出电极A发生的电极反应式___。

(二)CO2的综合利用
(1)CO2与CH4经催化重整制得合成气:
反应Ⅰ.CH4(g)H+CO2(g)2CO(g)+2H2(g)△H1
已知氢气、一氧化碳和甲烷的标准燃烧热(25℃)如表所示
物质 | H2(g) | CO(g) | CH4(g) |
标准燃烧热△H/kJmol﹣1 | ﹣285.8 | ﹣283.0 | ﹣890.3 |
则反应I的△H=___kJmol﹣1。
(2)用CO2催化加氢制取二甲醚的反应为:反应Ⅱ.2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g),在10L恒容密闭容器中,均充入2mol CO2和6moH2,分别以铱(Ir)和铈(Ce)作催化剂,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图1。
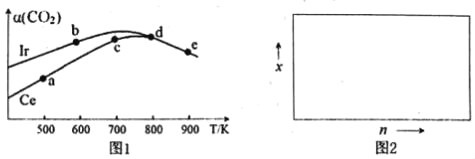
①根据图1,下列说法不正确的是___。
A.反应Ⅱ的△H<0,△S<0
B.用Ir和Ce作催化剂时,反应Ⅱ的活化能更低的是Ce
C.状态d时,v(正)<v(逆)
D.从状态b到d,α(CO2)先增大后减小,减小的原因可能是温度升高平衡逆向移动
②状态e(900K)时,α(CO2)=50%,则此时的平衡常数K=___。
③若H2和CO2的物质的量之比为n:1,900K时相应平衡体系中二甲醚的物质的量分数为x,请在图2中绘制x随n变化的示意图。_______
查看答案和解析>>
科目: 来源: 题型:
【题目】某黄色溶液中可能含有Na+、NH4+、Fe2+、Fe3+、Cl﹣、SO42﹣、CO32﹣等离子(不考虑水的电离和离子的水解)。某同学为了确定其组分,设计并完成了如下实验:

下列说法正确的是( )
A.c(Fe3+)一定为0.2 molL﹣1
B.c(Cl﹣)至少为0.2 molL﹣1
C.Na+'、SO42﹣一定存在,NH4+一定不存在
D.Na+、Fe2+可能存在,CO32﹣一定不存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com