
科目: 来源: 题型:
【题目】自然界水体中的碳元素主要以碳酸盐、碳酸氢盐和有机物形式存在。水体中有机物含量是水质的重要指标,常用总有机碳衡量(总有机碳=![]() )。
)。
某学生兴趣小组用如下实验方法测定采集水样的总有机碳。

步骤1:量取50 mL水样,加入足量硫酸,加热,通N2,并维持一段时间(装置见右图,夹持类仪器省略)。
步骤2:再向水样中加入过量的K2Cr2O7溶液(可将有机物中的碳元素氧化成CO2),加热,充分反应,生成的CO2完全被100 mL 0.205 mol·L-1的Ba(OH)2溶液吸收。
步骤3:将吸收CO2后的浊液过滤并洗涤沉淀,再将洗涤得到的滤液与原滤液合并,加水配制成500 mL溶液。量取25.00 mL溶液于锥形瓶中,加入指示剂,并滴加0.050 00 mol·L-1的H2C2O4溶液,发生反应:Ba(OH)2+H2C2O4===BaC2O4↓+2H2O,恰好完全反应时,共消耗H2C2O4溶液20.00 mL。
(1)步骤1的目的是________。
(2)计算水样的总有机碳(以mg·L-1表示),并写出计算过程。____________
(3)用上述实验方法测定的水样总有机碳一般低于实际值,其原因可能是__________________________________________。
(4)高温燃烧可将水样中的碳酸盐、碳酸氧盐和有机物所含碳元素转化为CO2,结合高温燃烧的方法,改进上述实验。
①请补充完整改进后的实验方案:取V L的水样,分为两等份;将其中一份水样高温燃烧,测定生成CO2的物质的量为n1 mol;____________________________________,测定生成CO2的物质的量为n2 mol。
②利用实验数据计算,所取水样的总有机碳为________mg·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】随着科学的发展,可逐步合成很多重要的化工产品,如用作照相定影剂的硫代硫酸钠(俗称大苏打),用于填充汽车安全气囊的叠氮化钠(NaN3),某化学兴趣小组拟制备硫代硫酸钠晶体和NaN3。
I.制备硫代硫酸钠晶体。
查阅资料:Na2S2O3易溶于水,向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3。实验装置如图所示(省略夹持装置):
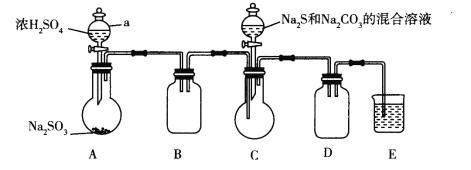
(1)组装好仪器后,接下来应该进行的实验操作是_____,然后加入试剂。仪器a的名称是_______;E中的试剂最好是__________.(填标号),作用是______________。
A.澄清石灰水B.NaOH溶液 C.饱和NaHSO3溶液
(2)已知五水合硫代硫酸钠的溶解度随温度升高显著增大。待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经_________(填操作名称)、过滤、洗涤、干燥,得到产品,过滤时用到的玻璃仪器有______________。
Ⅱ.实验室利用如图装置(省略夹持装置)模拟工业级NaN3的制备。已知:2NaNH2+N2O![]() NaN3+NaOH+NH3。
NaN3+NaOH+NH3。
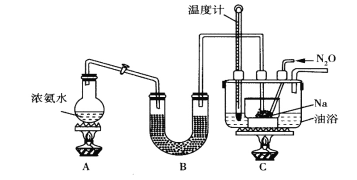
(1)装置B中盛放的药品为__________
(2)实验中使用油浴而不用水浴的原因是__________________________。
(3)氨气与熔融的钠反应生成NaNH2的化学方程式为_________________。
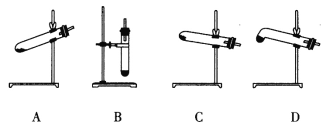
(4)N2O可由NH4NO3(熔点为169.6oC)在240oC下分解制得,应选择的气体发生装置是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)中国的高铁技术居于国际领先地位。
① 高铁座椅内填充有聚氨酯软质泡沫。聚氨酯属于_______(填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
② 高铁信息传输系统中使用了光导纤维。光导纤维的主要成分是_______(填字母)。
a.铜 b.石墨 c.二氧化硅
③ 高铁轨道建设需用大量水泥。生产水泥的主要原料为黏土和_________(填字母)。
a.石灰石 b.粗盐 c.纯碱
(2)营养平衡、合理用药是保证人体健康和生活质量的重要途径。
① 在氢、钠、铁这三种元素中,属于人体生命活动必需微量元素的是____。(填元素符号)
② 下列物质中,具有抗菌消炎疗效的是____(填字母)。
a.氨基酸 b.阿斯匹林 c.青霉素
③ 如图为某品牌鸡精标签的一部分,其中能水解生成氨基酸的配料是_____,属于着色剂的是_____,属于防腐剂的是_____。

(3)为了减轻我市的雾霾状况,《苏州市市区禁止燃放烟花爆竹规定》明确规定,自2017年1月1日起,姑苏区全区,苏州工业园区、高新区、吴中区、相城区、吴江区各区部分区域禁止燃放烟花爆竹。
① 燃煤是形成雾霾天气的罪魁祸首之一。向煤中加入一定量的石灰石进行“____”处理,可以减少SO2的排放。该反应的化学方程式为_____________________。
② 汽车尾气中含有污染大气的NO和CO。给汽车排气管加装“催化转化器”,可使CO和NO反应生成无毒无污染的气体,反应的化学方程式为____________。
③ 含铬元素的废水必须治理达标。某兴趣小组探究含铬(Cr2O72ˉ)废水的处理方法,制定的方案是先用(NH4)2Fe(SO4)2将Cr2O![]() 转化为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3。该过程中的氧化剂为______;该方案处理后的废水中因含有大量______(填离子符号),会导致水体富营养化。
转化为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3。该过程中的氧化剂为______;该方案处理后的废水中因含有大量______(填离子符号),会导致水体富营养化。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关物质的转化关系如下图所示。A是生石灰的主要成分,B是一种具有漂白性的无色气体,D是一种常见的无色液体,F是某种补血剂的有效成分,G是一种常见的强酸,H的摩尔质量为72 g·mol-1。

(1)A的化学式为____________。
(2)D的电子式为____________。
(3)写出反应①的化学方程式:________________________。
(4)写出反应②的离子方程式:________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】T℃下,三种硫酸盐MSO4,(M表示Pb2+或Ba2+或Sr2+)的沉淀溶解平衡曲线如图所示。已知pM=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是( )
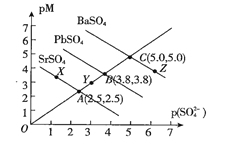
A.BaSO4在任何条件下都不可能转化成PbSO4
B.X点和Z点分别是SrSO4和BaSO4的饱和溶液,对应的溶液中c(M)=c(SO42-)
C.在ToC时,用0.01mol.L-1Na2SO4溶液滴定20mL浓度均是0.01mol.L-1的Ba(NO3)2和Sr(NO3)2的混合溶液,Sr2+先沉淀
D.ToC下,反应PbSO4(s)+Ba2+(aq)![]() BaSO4(s)+Pb2+(aq)的平衡常数为102.4
BaSO4(s)+Pb2+(aq)的平衡常数为102.4
查看答案和解析>>
科目: 来源: 题型:
【题目】氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上,工作原理如图所示,其中各电极未标出。下列有关说法错误的是( )
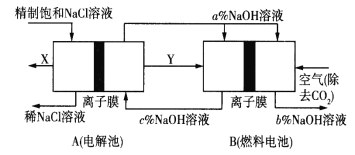
A.A池中右边加入NaOH溶液的目的是增大溶液的导电性
B.两池工作时收集到标准状况下气体X为2.24L,则理论上此时充入标准状况下的空气(不考虑去除CO2的体积变化)的体积约为5.6L
C.A为阳离子交换膜、B为阴离子交换膜
D.氢氧化钠的质量分数从大到小的顺序为b%>a%>c%
查看答案和解析>>
科目: 来源: 题型:
【题目】现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是( )

A.该有机物的分子式为:C18H30N3O8P2Cl
B.该有机物能够发生加成反应、取代反应、不能发生氧化反应
C.该有机物苯环上的1-溴代物只有2种
D.1mol该有机物最多能和8molNaOH发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组用打磨过的铝片进行如下实验,下列分析不合理的是( )
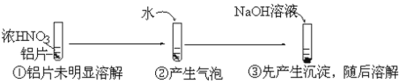
A.①中铝片发生了钝化
B.②中产生的气泡是氮氧化合物,不是氢气
C.③中沉淀溶解的离子方程式是![]()
D.②中加水稀释过程中,仅发生了氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】有关下列物质的用途,叙述不正确的是( )
A.氨容易液化,常用作制冷剂
B.浓硫酸可作干燥剂,但不可干燥![]() ,因为浓硫酸具有强氧化性,
,因为浓硫酸具有强氧化性,![]() 具有还原性
具有还原性
C.硅胶可用于袋装食品或药品的干燥剂,也可用作催化剂的载体
D.![]() 均可用于自来水的杀菌、消毒剂,而明矾可作净水剂
均可用于自来水的杀菌、消毒剂,而明矾可作净水剂
查看答案和解析>>
科目: 来源: 题型:
【题目】铝碳酸镁 [AlaMgb(CO3)c(OH)deH2O] 用于治疗慢性胃炎。称取3.01 g铝碳酸镁样品,溶于50 mL 2 molL -1的盐酸(过量),收集到气体112 mL(标准状况);往所得溶液中加入40 mL 3 molL-1的NaOH溶液,过滤,将所得沉淀洗涤、干燥、称量得固体1.74 g;再将滤液稀释到100 mL,测得溶液中OHˉ的浓度为0.1 molL -1。由计算可得e的值为
A. 4B. 5C. 7D. 8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com