
科目: 来源: 题型:
【题目】I:磷酸氯喹是治疗新型肺炎的潜力药。磷酸是合成该药的初级原料之一,沸点高,难挥发。化学兴趣小组设计了合成磷酸的流程如图。回答下列问题

(1)将一定量的红磷与氯气置于容积为2L的恒温恒容(温度,体积均不变)反应器中制取A,各物质的物质的量与时间关系如下图

①该反应的化学方程式为___________(A用化学式表示)
②前10s的平均反应速率v(Cl2)=_______
(2)将A加入热水中,生成两种酸。一种为磷酸,反应过程各元素化合价不变。
①另一种是酸C是___________(写名称)
②A与热水反应的化学方程式为____________。
II(1)将反应Cu+2FeCl3=2FeCl2+CuCl2设计成原电池,完成该原电池的装置示意图______________,并作相应标注(标明正负极材料及电解质溶液的名称,电子移动方向、离子移动方向)。
(2)该装置中负极的电极方程式为________。
(3)若在反应过程中电极减轻3.2g,则在导线中通过电子__________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5℃,100℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%、单宁酸(Ka约为104,易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如下图所示。

索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题:

(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是______________,圆底烧瓶中加入95%乙醇为溶剂,加热前还要加几粒______________。
(2)提取过程不可选用明火直接加热,原因是______________,与常规的萃取相比,采用索氏提取器的优点是______________。
(3)提取液需经“蒸馏浓缩”除去大部分溶剂,与水相比,乙醇作为萃取剂的优点是______________。“蒸馏浓缩”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管之外,还有______________(填标号)。
A.直形冷凝管 B.球形冷凝管C.接收瓶D.烧杯
(4)浓缩液加生石灰的作用是中和______________和吸收______________。
(5)可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小孔的滤纸上凝结,该分离提纯方法的名称是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。回答问题:
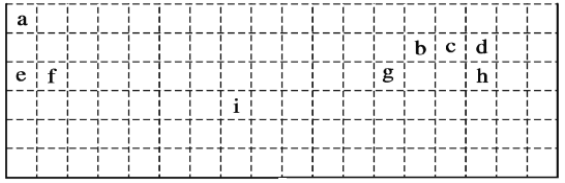
(1)有人认为在元素周期表中,有一种元素也可以放在第ⅦA族,你认为该元素为___(填元素符号)。
(2)实验室制ca3的化学反应方程式为_______________。
(3)g的氧化物与e的最高价氧化物对应水化物反应的离子方程式为_____________。
(4)设计实验验证b、c非金属性的强弱 _________________。
(5)i在周期表中的位置为___。i对应的单质与h对应的单质反应的化学方程式为_________。
(6)e2d2的电子式为______;用电子式表示fCl2的形成过程________________。
(7)写出工业冶炼元素g的单质的化学方程式___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的最高价氧化物为无色晶体,它由两种离子构成,已知其阴离子构型为平面三角形,则其阳离子的构型和阳离子中氮的杂化方式为( )
A. 平面三角形 sp2杂化B. V形 sp2杂化
C. 三角锥形 sp3杂化D. 直线形 sp杂化
查看答案和解析>>
科目: 来源: 题型:
【题目】CoCl3·4NH3用H2SO4溶液处理再结晶,SO42-可以取代化合物中的Cl-,但NH3的含量不变,用过量的AgNO3处理该化合物,有含量三分之一的氯以AgCl析出,这种化合物应该是( )
A. [Co(NH3)4]Cl3B. [Co(NH3)4Cl3]C. [Co(NH3)4Cl2]ClD. [Co(NH3)4Cl]Cl2
查看答案和解析>>
科目: 来源: 题型:
【题目】环戊二烯( )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:![]() (g)=
(g)= ![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
(g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
H2(g)+ I2(g)=2HI(g) ΔH2=﹣11.0 kJ·mol 1 ②
对于反应:![]() (g)+ I2(g)=
(g)+ I2(g)=![]() (g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。

A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L1
(4)环戊二烯可用于制备二茂铁(Fe(C5H5)2结构简式为 ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。

该电解池的阳极为____________,总反应为__________________。电解制备需要在无水条件下进行,原因为_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X、Y、W、Q四种元素的原子最外层电子数之和为23。则下列说法中正确的是( )

A. 钠与W形成的化合物Na2W2中既含离子键又含非极性共价键
B. 由Z与Y组成的物质在熔融时能导电
C. 氢化物的沸点:Y<Q
D. X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目: 来源: 题型:
【题目】I.下列7种化学符号:18O;14C;23Na;14N;32S;16O;1H2
(1)表示核素的符号共______种。
(2)互为同位素的是______和______。
(3)质量数相等,但不能互为同位素的是______和______。
(4)中子数相等,但质子数不相等的是______和______。
II.(1)写出下列物质的电子式: NH3 _____________, CO2______。
(2)2.2g铵根![]() 的中子数是___,核外电子数是____,某微粒含有一个原子核,核中有 17个质子,20个中子,核外有18个电子,该粒子的化学符号是____。
的中子数是___,核外电子数是____,某微粒含有一个原子核,核中有 17个质子,20个中子,核外有18个电子,该粒子的化学符号是____。
(3)已知断开 1mol H—H 键、1mol I—I 键、1mol H—I 键分别需要吸收的能量为 436kJ、151kJ、299kJ,则由 1mol H2和 1mol I2生成 2mol HI会_____(“放出”或“吸收”)_____kJ 的热量。
(4)现有下列物质:①H2 ②Na2O2 ③NaOH ④H2O2 ⑤CaCl2 ⑥NH4NO3 ⑦H2S,只由离子键构成的物质是_____(填序号,下同),由离子键和非极性共价键构成的物质是________,属于共价化合物的是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用铝土矿![]() (主要成分为
(主要成分为![]() ,含FeO杂质)为原料冶炼铝的工艺流程如下:
,含FeO杂质)为原料冶炼铝的工艺流程如下:

下列说法正确的是( )
A.试剂X可以是氢氧化钠溶液,也可以是盐酸溶液
B.反应①过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.反应②的化学方程式为CO2 + Na[Al(OH)4] = NaHCO3 + Al(OH)3↓
查看答案和解析>>
科目: 来源: 题型:
【题目】立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________(填标号)。
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:

①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为______________________。回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为______________________。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的___________(填化学式)。
③沉淀器中反应的离子方程式为______________________。
(3)成品中S2的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L1的I2KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L1Na2S2O3溶液滴定,反应式为I2+2![]() =2I+
=2I+![]() 。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为_________________,样品中S2的含量为______________(写出表达式)。
。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为_________________,样品中S2的含量为______________(写出表达式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com