
科目: 来源: 题型:
【题目】实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO![]() N2+3Cu+3H2O,试回答:
N2+3Cu+3H2O,试回答:
(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)] 时,请用下图所列仪器设计一个简单的实验方案。
(2)①请写出用下图装置制备氨气的化学反应方程式___________________。

②仪器连接的顺序为(用字母编号表示,仪器可重复使用) ______________________,(d)中浓硫酸的作用是___________,实验完毕时观察到(a)中的现象是______________________。
③列出计算Cu的相对原子质量的表达式:______________________。
(2)有同学认为NH3与CuO反应生成的红色物质中可能含有Cu2O。已知Cu2O是红色粉末,在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu2+和Cu。
①若CuO未完全分解,则所测定的Cu的相对原子质量会______________(偏大或偏小)。
②请设计一个简单的实验检验该红色物质中是否含有Cu2O________________。
(3)在解决了问题(2)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取0.98 g Cu(OH)2固体,加热到80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末B。如下图所示:
据此可推得A为__________,且AB段发生的反应为_________________,
由此得到的热稳定性的结论是____________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1L0.1molL﹣1CH3COOH溶液中加入0.1molCH3COONa固体,平衡后则溶液中![]() ___(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度间的一个等式:______
___(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度间的一个等式:______
(2)常温下向20mL 0.1molL﹣1Na2CO3溶液中逐滴加入0.1molL﹣1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:
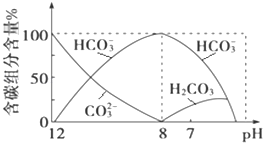
回答下列问题:
①在同一溶液中,H2CO3、HCO3﹣、CO32﹣___(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有_____、___,溶液中含量最多的三种微粒的物质的量浓度的大小关系为____;
③已知在25℃时,CO32﹣水解反应的平衡常数即水解常数Kh═2×10﹣4 molL﹣1,当溶液中c(HCO3﹣):c(CO32﹣)=2:1时,溶液的pH=_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A. Fe与S混合加热生成FeS2
B. NaHCO3的热稳定性大于Na2CO3
C. 过量的铜与浓硝酸反应有一氧化氮生成
D. 白磷在空气中加热到一定温度能转化为红磷
查看答案和解析>>
科目: 来源: 题型:
【题目】莫尔盐是硫酸盐的一种复盐,是一种重要的化学试剂,它的水溶液中加入KSCN不显红色,并有如图所示的反应:
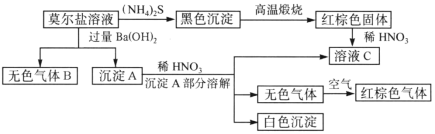
根据以上关系,按要求填空:
(1)可用检验气体B__________________。
(2)莫尔盐的化学式为____________________。
(3)部分沉淀A与稀HNO3反应的离子方程式是_____________________。
(4)古代硫酸的制法是隔绝空气锻烧绿矾(FeSO4·7H2O),将蒸气冷却可制得一种无色粘稠的液体“绿矾油”,剩余的固体为红棕色。(已知SO3的熔点是16.8°C,沸点是44.8°C,再加矾受热分解的产物)

①装置的连接顺序为______________。
②B的作用是验证该反应有水生成,其中的试剂为_________,实验过程中发现F中溶液褪色,D中出现无色粘稠液体,则煅烧绿矾的反应方程式为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)CO还原脱硝技术可有效降低烟气中的NOx的排放量。回答下列问题:
CO还原NO的脱硝反应:2CO(g)+2NO(g)2CO2(g)+N2(g) △H
已知:CO(g)+NO2(g)CO2(g)+NO(g) △H1=—226kJmol—1
N2(g)+2O2(g)2NO2(g) △H2=+68kJmol—1
N2(g)+O2(g)2NO(g) △H3=+183kJmol—1
脱硝反应△H=______,该反应向正反应方向自发进行的倾向很大,其原因是_______,有利于提高NO平衡转化率的条件是(写出两条)________、___________。
(2)直接供氨式燃料电池是以NaOH溶液为电解质的.电池反应为:4NH3+3O2=2N2+6H2O,则负极电极反应式为_________。
(3)用甲醇燃料电池作为直流电源,设计如图装置制取Cu2O,电解总反应为:2Cu+H2O=Cu2O+H2↑。写出阳极的电极反应式_______。
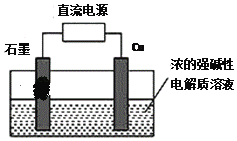
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下,在三个干燥的烧瓶内分别装有:①干燥且纯净的NH3;②含一半空气的氯化氢气体;③NO2和O2体积比为4:1的混合气体。然后分别做喷泉实验,实验结束后假设三个烧瓶中所得溶液不扩散,则三个烧瓶中所得溶液的物质的量浓度之比为
A.5:5:4B.2:1:2C.1:1:1D.无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】已知K、Ka、Kb、Kw、Kh、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、弱碱的电离平衡常数、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是______。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中,Kw=Ka·Kh
(2)25℃时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显_____(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离平衡常数Kb=____。
(3)高炉炼铁中发生的反应有FeO(s)+CO(g)![]() Fe(s)+CO2(g) ΔH<0。该反应的平衡常数表达式K=_____;已知1100 ℃时,K=0.25,则平衡时CO的转化率为________;在该温度下,若测得高炉中c(CO2)=0.020 mol·L-1,c(CO)=0.1 mol·L-1,则此时反应速率是υ(正)_____υ(逆)(填“>”“<”或“=”)。
Fe(s)+CO2(g) ΔH<0。该反应的平衡常数表达式K=_____;已知1100 ℃时,K=0.25,则平衡时CO的转化率为________;在该温度下,若测得高炉中c(CO2)=0.020 mol·L-1,c(CO)=0.1 mol·L-1,则此时反应速率是υ(正)_____υ(逆)(填“>”“<”或“=”)。
(4)已知高温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1 mol·L-1的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是______(已知lg2=0.3)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图,下列说法正确的是( )
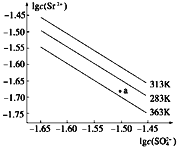
A. 283 K时,图中a点对应的溶液是不饱和溶液
B. 三个不同温度下,363 K时Ksp(SrSO4)最大
C. 温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
D. 283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 稀硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com