
科目: 来源: 题型:
【题目】I.分别取一定质量的甲烷、乙炔、苯、己烯、甲苯,完全燃烧后都生成m molCO2和nmolH2O。
(1)若m=n,该烃是____;
(2)若m=2n,该烃是____;
(3)若4m=7n,该烃是____;
II.蒽( )与苯炔(
)与苯炔(![]() )反应生成化合物X(立体对称图形),如图所示:
)反应生成化合物X(立体对称图形),如图所示:
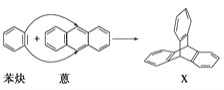
(1)蒽与X都属于(填字母)________
a.环烃 b.苯的同系物 c.不饱和烃
(2)苯炔不具有的性质是(填字母)_______
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
(3)下列物质中,能发生加成反应,也能发生取代反应,同时能使溴水因加成反应而褪色,还能使酸性高锰酸钾溶液褪色的是____
A.![]() B.C6H14
B.C6H14
C.![]() D.
D.![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】已知 NA是阿伏加德罗常数的值,下列说法正确的是
A.32gS8与 S6(![]() )的混合物中所含共价键数目为NA
)的混合物中所含共价键数目为NA
B.1L0.1mol L-1H2C2O4溶液中含 C2O42- 离子数为0.1NA
C.2molNO与 2molO2在密闭容器中充分反应,转移的电子数为 8NA
D.标准状况下 22.4L氯气与甲烷的混合气体,光照时充分反应生成 HCl分子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】2,5-二羟基苯甲酸甲酯俗称龙胆酸甲酯,可由龙胆酸与甲醇酯化得到,是合成制药中的常见中间体。其结构如图所示。
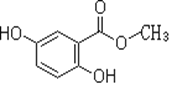
回答以下问题:
(1)龙胆酸甲酯的分子式为__________
(2)下列有关龙胆酸甲酯的描述,正确的是_____(填字母)。
a.能发生消去反应 b.能与氢气发生加成反应 c.能与浓溴水反应
(3)龙胆酸甲酯与足量氢氧化钠溶液反应的化学方程式_________ 。
(4)写出满足下列条件的龙胆酸的两种同分异构体的结构简式_______、_______。
①能发生银镜反应; ②能使FeCl3溶液显色;
③酯类 ④苯环上的一氯代物只有两种
查看答案和解析>>
科目: 来源: 题型:
【题目】聚酰亚胺是重要的特种工程材料,广泛应用在航空、纳米、激光等领域。某聚酰亚胺的合成路线如图所示(部分反应条件略去):
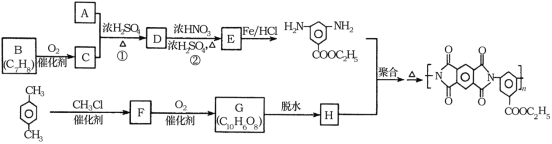
已知:①有机物A的质谱与核磁共振氢谱图如图所示:

②![]()
③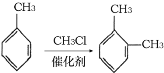
回答下列问题:
(1)A的名称是________________。
(2)反应②的反应类型是________________。
(3)反应①的化学方程式是________________。
(4)F的结构简式是________________。
(5)同时满足下列条件的G的同分异构体共有____种(不含立体结构);写出其中一种的结构简式:________________。
①能发生银镜反应
②发生发生水解反应,其水解产物之一能与FeC13溶液发生显色反应
③1mol该物质最多能与8molNaOH反应
(6)参照上述合成路线,以间二甲苯和甲醇为原料(无机试剂任选)设计制备![]() 的合成路线:__________。
的合成路线:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钠、硫及其化合物用途非常广泛。回答下列问题:
(1)基态S原子价层电子的轨道表达式为________,基态Na原子电子占据最高能级的电子云轮廓图为________形。
(2)乙炔钠广泛用于有机合成,乙炔钠中存在________(填序号)。乙炔钠的熔沸点比S8高,原因是________。
A.金属键 B.σ键 C.π键 D.氢键
(3)NaN3是用于汽车安全气囊的产气药,N3—的空间构型为________,N3—中心原子的杂化方式是____________________。
(4)![]() 的晶格能可通过图示中的born—Haber循环计算得到,Na原子的电子电离能为________kJ·mol-1,Cl-Cl的键能为_______kJ·mol-1,Cl的电子亲和能为_______kJ·mol-1,NaCl的晶格能为________kJ·mol-1。
的晶格能可通过图示中的born—Haber循环计算得到,Na原子的电子电离能为________kJ·mol-1,Cl-Cl的键能为_______kJ·mol-1,Cl的电子亲和能为_______kJ·mol-1,NaCl的晶格能为________kJ·mol-1。
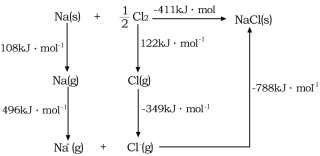
(5)已知![]() 的晶胞结构如图所示,晶体密度为1.86g·cm-3。设NA为阿伏加德罗常数的数值,则晶胞参数a=________
的晶胞结构如图所示,晶体密度为1.86g·cm-3。设NA为阿伏加德罗常数的数值,则晶胞参数a=________![]() (列出计算式)。
(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)CO还原NO的反应为2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)H=-746kJ·mol-1。
2CO2(g)+N2(g)H=-746kJ·mol-1。
写出两条有利于提高NO平衡转化率的措施______________、______________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
H。恒容恒温条件下,向体积相同的甲、乙、丙三个容器中分别加入足量的焦炭和一定量的NO,测得各容器中NO的物质的量[n(NO)]随反应时间(t)的变化情况如表所示:
t/min n(NO)/mol 容器 | 0 | 40 | 80 | 120 | 160 |
甲/400℃ | 2.00 | 1.5 | 1.10 | 0.80 | 0.80 |
乙/400℃ | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
丙/T℃ | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①H______________0(填“>”或“<”);
②乙容器在160min时,v正_________v逆(填“>”、“<”或“=”)。
(3)某温度下,向体积为2L的恒容真空容器中通入2.0molNO2,发生反应:2NO2(g)![]() N2O4(g)H=-57.0kJ·mol-1,已知:v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数。测得NO2的体积分数[x(NO2)]与反应时间(t)的关系如表:
N2O4(g)H=-57.0kJ·mol-1,已知:v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数。测得NO2的体积分数[x(NO2)]与反应时间(t)的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 |
x(NO2) | 1.0 | 0.75 | 0.52 | 0.50 | 0.50 |
①![]() 的数值为______________;
的数值为______________;
②已知速率常数k随温度升高而增大,则升高温度后k1增大的倍数___________k2增大的倍数(填“>”、“<”或“=”)。
(4)用间接电化学法除去NO的过程,如图所示:
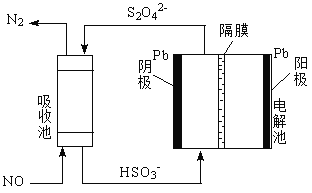
①已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:______________;
②用离子方程式表示吸收池中除去NO的原理:______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表示物质结构的化学用语正确的是( )
A. 乙烯的结构简式:CH2CH2 B. 异丙基的结构简式:-CH(CH3)2
C. 羟基的电子式: ![]() D. 新戊烷的结构简式:
D. 新戊烷的结构简式:
查看答案和解析>>
科目: 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂。下图是草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
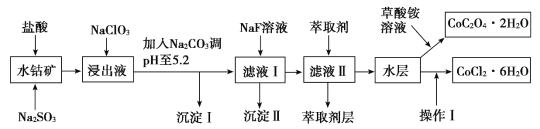
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子方程式为______________。
(2)1molNaClO3在浸出液中发生反应时,转移的电子数为_________。
(3)加入Na2CO3调pH至5.2只得到两种沉淀,则沉淀I的成分为______________(填化学式,下同);萃取剂层含锰元素,则沉淀Ⅱ的主要成分为______________。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3、________、________、过滤、洗涤、减压烘干等过程。
(5)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中,不同温度范围内得到一种不同的固体物质,其质量如表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,整个受热过程产生的气体只有水蒸气和CO2,则290~320℃范围内,剩余固体物质的化学式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】取代反应是有机化学中一类重要的反应,下列反应不属于取代反应的是
A. CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
B. ![]() +Br2
+Br2![]() +HBr
+HBr
C. 2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
D. CH3CH2Br+NaOH![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、M、W是前四周期元素,原子序数依次增大,X元素原子最外层电子数是内层的2倍,Y的原子半径是在同周期中最大;Z元素原子的最外层电子数比次外层电子数少2,M原子外围电子排布式为3dn4sn;W的内层电子己全充满,最外层只有2个电子。
请回答下列问题:
(1)Y元素在周期表中的位置是_________; W2+离子的价电子排布式为__________。
(2)X能与S、氮、氧二种元素构成化合物XO(NH2)2,其中X原子和N原子的杂化方式为分别为_____、____,该化合物分子中的π键与![]() 键的个数之比是____;该物质易溶于水的主要原因是____。
键的个数之比是____;该物质易溶于水的主要原因是____。
(3)己知Be和A1元素处于周期表中对角线位置,化学性质相似,请写出Y元素的最高价氧化物对应水化物与Be相互反应的化学方程式:____________。
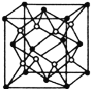
(4)M晶体的原子堆积如图所示,则该晶体的堆积方式为________,晶体中M原子的配位数是_____。某M配合物的化学式是[M(H2O)5C1]Cl2·H2O,1mol该配合物中含配位键是_____mol。

(5)Y离子和Z离子比较,半径较大的是__________(填离子符号)元素Y与元素Z形成了晶体的晶胞结构是如图所示的正方体,每个Y离子周围与它最接近的Y离子有__________个。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com