
科目: 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18gcm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。
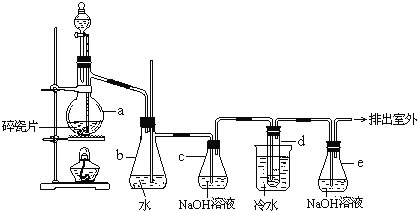
完成下列填空:
(1)在此制备实验中,要尽可能迅速把反应温度升高到170℃左右,最主要目的是___________。
a. 引发反应 b. 加快反应速率 c. 防止乙醇挥发 d. 减少副产物乙醚生成
(2)写出本题中制备1,2-二溴乙烷的两个化学反应方程式:_______________________;___________________________。
(3)安全瓶b可以防止倒吸,并可以检验实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象_________________________________________。
(4)容器c中NaOH溶液的作用是______________________________________。
(5)判断该制备反应已经结束的最简单方法是____________________________________。
(6)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的一种原因__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上合成乳酸(![]() )的一种途径如下:
)的一种途径如下:
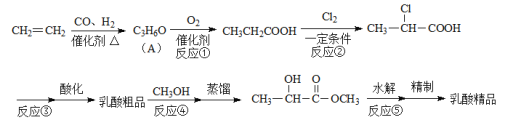
完成下列填空:
(1)乳酸中的官能团名称是__________________。A的结构简式是_____________________。
(2)反应②的反应类型是____________________。反应③的条件是_____________________。
(3)反应④的化学方程式为_______________________________________________________。
(4)聚乳酸是一种常用的可降解塑料,由乳酸聚合得到,其结构如下:
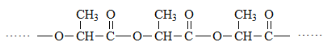
聚乳酸降解时,会产生自催化效应(降解的速度会越来越快),请解释原因。___________________________________________________________。
(5)设计一条由丙烯制备丙酸的合成路线。________________________(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目: 来源: 题型:
【题目】请阅读下列材料,完成下面小题。
联合国将2019年定为“国际化学元素周期表年”以纪念门捷列夫发现元素周期律150周年。元素周期律把元素及其化合物纳入一个统一的理论体系,为系统研究元素及其化合物提供了科学方法,为发现和探索新元素、新物质提供了有效思路。
1. 为纪念门捷列夫,科学家将1955年人工合成的一种新元素用符号“Md”表示,中文命名为“钔”。核素![]() Md的中子数为(______)
Md的中子数为(______)
A. 101 B. 359 C. 258 D. 157
2. O和S都属于元素周期表ⅥA元素,它们原子结构中相同的是(______)
A. 质子数 B. 电子层数 C. 电子数 D. 最外层电子数
3. 锂是第2周期ⅠA族元素,下列有关锂元素性质推测正确的是(______)
A. 金属性比钠弱
B. 最高化合价为+2
C. 单质与水的反应比钠更剧烈
D. 原子半径比钠的大
查看答案和解析>>
科目: 来源: 题型:
【题目】已知五种短周期元素aX、bY、cZ、dR、eW存在如下关系:① X、Y同主族,R、W同主族 ②![]() ;a+b=
;a+b=![]() (d+e);
(d+e);![]() =c-d,下列有关说法不正确的是
=c-d,下列有关说法不正确的是
A.原子半径比较:r(W)>r(Z)>r(Y) >r(R)
B.X和Y形成的化合物中,阴阳离子的电子层相差1层
C.W的最低价单核阴离子的失电子能力比R的强
D.Z、Y最高价氧化物对应的水化物之间可以相互反应
查看答案和解析>>
科目: 来源: 题型:
【题目】Ca(NO2)2常用于电子、仪表及冶金工业。某化工厂采用下列方案制备Ca(NO2)2,并除去氮氧化物(大气污染物),工艺流程如图:
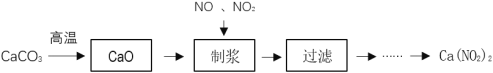
①NO2+NO+Ca(OH)2═Ca(NO2)2+H2O;4NO2+2Ca(OH)2═Ca(NO2)2+Ca(NO3)2+2H2O
②在酸性条件下2![]() +4H++2I-=2NO↑+I2+2H2O;2
+4H++2I-=2NO↑+I2+2H2O;2![]() +I2=
+I2=![]() +2I-
+2I-
(1)为加快CaCO3的分解速率,可以采取的措施有___(任写一种)。
(2) “制浆”过程中生成Ca(OH)2的化学方程式是___。
(3)该工艺流程中需控制NO和NO2物质的量之比接近1∶1。若n(NO2)∶n(NO)>1∶1,则会导致___。
(4)Ca(NO2)2样品纯度的测定
①准确称取1.50gCa(NO2)2样品配成250ml的溶液,取25mL于锥形瓶中,加入过量的KI溶液、淀粉溶液,滴加稀硫酸,溶液变蓝。
②用0.1mol·L-1Na2S2O3溶液滴定溶液至无色,消耗Na2S2O3溶液的体积为20.00mL,据此计算样品中Ca(NO2)2的纯度,写出计算过程___。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三分子中含相同数目的质子数,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如图所示:
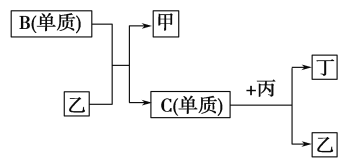
(1)写出B+乙→甲+C的化学反应方程式___________________________
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是________。(填写序号)
①A②B③C④D
(3)依据下列条件可以进一步确定上述第四种元素:①甲与丙以及乙与丙均能够发生反应
②甲、丙都是无色、有刺激性气味的物质。
据此,请回答下列问题:写出上述第四种元素在周期表中第_______周期第_______族;写出C+丙→乙+丁的化学反应方程式_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】由铜片、锌片和200 mL 稀H2SO4组成的原电池中,若锌片只发生电化学反应,则当铜片上共放出3.36 L(标准状况)气体时,H2SO4恰好完全消耗。求:
(1)反应中消耗的锌的质量是多少______?
(2)有多少个电子通过了导线______?
(3)原稀H2SO4的物质的量浓度是多少______?
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆
B.水分子中O-H键的键能很大,因此水的沸点较高
C.Na2O2中 既含有离子键又含有共价键,但Na2O2属于离子化合物
D.1 mol NH3中含有共用电子对数为4NA (NA为阿伏加德罗常数的值)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.硫酸铜溶液中加过量的氨水:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
B.用食醋检验牙膏中碳酸钙的存在:CaCO3+2H+=Ca2++CO2↑+H2O
C.将去膜的铝片投入到NaOH溶液中:2Al+2OH—+6H2O=2[Al(OH)4]— +3H2↑
D.用碘化钾淀粉溶液检验亚硝酸钠中NO2-的存在:NO2-+2I-+2H+=NO↑+I2+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.阅读下列材料后,回答相应问题:一个体重50kg的健康人的体内含铁2g。这2g铁在人体内不是以单质的形式存在的,而是以Fe2+和Fe3+的形式存在。Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的Fe3+转化为Fe2+,有利于铁的吸收。
⑴人体中经常进行![]() 的转化,A转化中Fe2+发生________(填“氧化”或“还原”,下同)反应,B转化中Fe3+做________剂。
的转化,A转化中Fe2+发生________(填“氧化”或“还原”,下同)反应,B转化中Fe3+做________剂。
⑵“服用维生素C,可使食物中的Fe3+转化为Fe2+”,这句话指出维生素C在这一反应中做________剂,具有________性。
Ⅱ.某化工厂排出的废液中含有Ag+、Ba2+、Cu2+三种金属阳离子,现欲用CO32-、OH-、Cl-三种不同的阴离子分别将上述金属阳离子逐一形成沉淀除去。加入阴离子的正确顺序是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com