
科目: 来源: 题型:
【题目】锂(Li)—空气电池的工作原理如图所示下列说法不正确的是

A. 金属锂作负极,发生氧化反应
B. Li+通过有机电解质向水溶液处移动
C. 正极的电极反应:O2+4e—==2O2—
D. 电池总反应:4Li+O2+2H2O==4LiOH
查看答案和解析>>
科目: 来源: 题型:
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
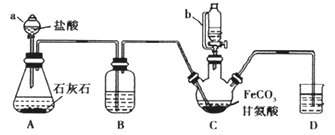
有关物质性质如下表
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
Ⅰ合成:装置C中盛有0.2 mol FeCO3和200 mL 1.0 mol·L1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置C中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器C的名称是___________;与a相比,仪器b的优点是_______。
(2)装置B盛装的试剂为_____________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和______________。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________________。
(5)过程II中洗涤操作为________。
(6)检验产品中是否含有Fe3+的最佳试剂是_________(写化学用语)。
(7)本实验制得15.3 g 甘氨酸亚铁(M=204g/mol),则其产率是_______%。
查看答案和解析>>
科目: 来源: 题型:
【题目】向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中Mg2+、NH4+、Al3+三种离子的物质的量之比为( )

A. 1∶1∶2B. 2∶2∶1
C. 1∶2∶2D. 9∶2∶4
查看答案和解析>>
科目: 来源: 题型:
【题目】天然气因含有少量H2S等气体开采应用受限。T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是

A.该脱硫过程需要不断添加Fe2(SO4)3溶液
B.脱硫过程O2间接氧化H2S
C.亚铁是血红蛋白的重要组成成分,FeSO4可用于治疗缺铁性贫血
D.《华阳国志》记载“取井火煮之,一斛水得五斗盐”,说明我国古代已利用天然气煮盐
查看答案和解析>>
科目: 来源: 题型:
【题目】贝诺酯是由阿司匹林、扑热息痛经化学法拼合制备的解热镇痛抗炎药,其合成反应式(反应条件略去)如下:
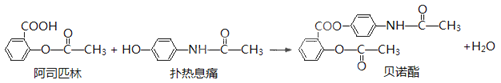
下列叙述错误的是
A. FeCl3溶液可区别阿司匹林和扑热息痛
B. 1mol阿司匹林最多可消耗2mol NaOH
C. 常温下贝诺酯在水中的溶解度小于扑热息痛
D. C6H7NO是扑热息痛发生类似酯水解反应的产物
查看答案和解析>>
科目: 来源: 题型:
【题目】t ℃时,两种碳酸盐MCO3(M表示X2+或Y2+)的沉淀溶解平衡曲线如图所示。已知:pM=-lgc(M2+),p(CO32-)=-lgc(CO32-),XCO3溶解度比YCO3大。下列说法正确的是
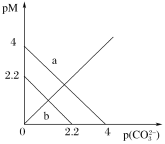
A.线b表示YCO3的溶解平衡曲线
B.a、b线上任意点均存在c(M2+)=c(CO32-)
C.t ℃时,XCO3(s)+Y2+(aq)![]() YCO3(s)+X2+(aq)平衡常数为K,其数量级为102
YCO3(s)+X2+(aq)平衡常数为K,其数量级为102
D.向YCO3悬浊液中加入饱和X(NO3)2溶液,可能有XCO3生成
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为某漂白剂的结构。已知:W、Y、Z是不同周期、不同主族的短周期元素,W、Y、Z原子最外层电子数之和等于X原子最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述错误的是
![]()
A.W、X对应的简单离子的半径:X>W
B.Y元素在周期表中的位置为二周期第IVA族
C.将W的氯化物的水溶液加热蒸干并灼烧可得到W的氧化物
D.该漂白剂结构中,Y、X原子的最外层均满足8电子结构。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
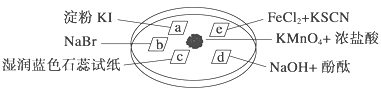
对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目: 来源: 题型:
【题目】石油是工业的血液,与我们的生产、生活息息相关。
某烃A是重要的石油化工产品。其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应。回答下列问题。
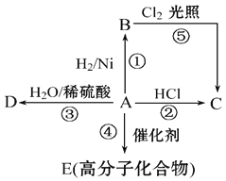
(1)物质A的工业制法是_____________________________。
(2)与A互为同系物的是______________________。(选填编号)
a CH3CH=CH2 b CH2=CHCH=CH2 c CH≡CH d CH3CH3
(3)高分子化合物E可用于制食品包装袋,写出其结构简式为_____________________;D是酒的主要成分,写出其结构简式为___________________________________。
(4)写出②⑤两步反应的化学方程式,并注明反应类型(有机物写结构简式)。
②__________________________________________反应类型________________
⑤__________________________________________反应类型________________
(5)苯是一种特殊的不饱和烃。若要鉴别苯与烯烃,可选用的试剂是______________。
(6)聚氯乙烯,简称PVC是一种在建筑材料、工业制品等方面广泛应用的通用塑料,若以乙炔为原料合成聚氯乙烯,请在方框内填写相应的物质,有机物写结构简式。
CH≡CH PVC
PVC
_____________________、_______________________
(7)异戊二烯是重要的有机化工原料,其结构简式为CH2=C(CH3)CH=CH2,它与溴水反应最多可以得到_________种产物。若烃X与异戊二烯具有相同的分子式,与Br2/CCl4反应后得到3-甲基-1,1,2,2-四溴丁烷,则烃X的结构简式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com