
科目: 来源: 题型:
【题目】已知热化学方程式:则下列说法正确的是
①CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1

A. H2的燃烧热为241.8kJ·mol-1
B. 由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH =-41.2kJ·mol-1
C. H2(g)转变成H2O(g)的化学反应一定要释放能量
D. 根据②推知反应H2(g) +1/2O2(g)=H2O(l):ΔH>-241.8 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组为研究原电池原理,设计如图装置。下列叙述正确的是( )
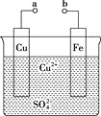
A. a和b不连接时,铁片上会有![]() 产生
产生
B. a和b用导线连接时,铁片上发生的反应为![]()
C. a和b用导线连接时,电子由a流向b
D. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于甲、乙、丙、丁四个图像的说法中,正确的是( )
A.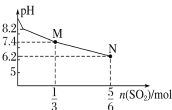 表示用1 L 1 mol·L-1 Na2SO3溶液吸收SO2时溶液pH随SO2的物质的量的变化,则M点时溶液中:c(SO32-)>c(HSO3)
表示用1 L 1 mol·L-1 Na2SO3溶液吸收SO2时溶液pH随SO2的物质的量的变化,则M点时溶液中:c(SO32-)>c(HSO3)
B.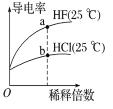 a点Kw的数值比b点Kw的数值大
a点Kw的数值比b点Kw的数值大
C.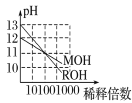 表示MOH和ROH两种一元碱的溶液分别加水稀释时的pH变化,由图可得碱性:ROH>MOH
表示MOH和ROH两种一元碱的溶液分别加水稀释时的pH变化,由图可得碱性:ROH>MOH
D.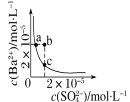 表示某温度时,BaSO4在水中的沉淀溶解平衡曲线,则加入Na2SO4可以使溶液由a点变到b点
表示某温度时,BaSO4在水中的沉淀溶解平衡曲线,则加入Na2SO4可以使溶液由a点变到b点
查看答案和解析>>
科目: 来源: 题型:
【题目】半导体光催化CO2机理如图甲所示,设计成电化学装置如图乙所示,则下列说法正确的是( )
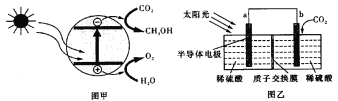
A.若导线上有4mol电子移动,则质子交换膜左侧产生22.4 L O2
B.装置中进行的总反应一定是自发的氧化还原反应
C.b极上的电极反应为:CO2+6H+-6e-=CH3OH+H2O
D.图乙中的能量转化形式为:光能→电能→化学能
查看答案和解析>>
科目: 来源: 题型:
【题目】合成EPR橡胶(![]() )广泛应用于防水材料、电线电缆护套、耐热胶管等;PC塑料(
)广泛应用于防水材料、电线电缆护套、耐热胶管等;PC塑料(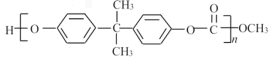 )透光性良好,可制作挡风玻璃以及眼镜等。它们的合成路线如下:
)透光性良好,可制作挡风玻璃以及眼镜等。它们的合成路线如下:
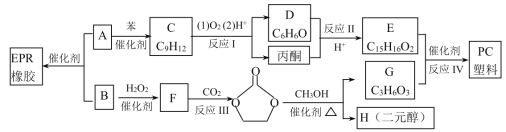
已知:①![]()
②(CH3)2C=CHCH3+H2O2![]()
![]() +H2O
+H2O
③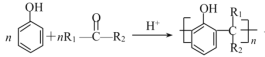 +nH2O
+nH2O
(1)A的名称为________,反应Ⅲ的反应类型为___________,H的结构简式为___________。
(2)在工业生产过程中,反应Ⅰ除了能得到高纯度的苯酚和丙酮之外,还能回收副产物![]() 和______________。
和______________。
(3)反应Ⅱ发生时,条件控制不当有可能生成高分子化合物,其结构简式可能是________。
(4)反应Ⅳ的化学方程式为_____________________________。
(5)有机物E满足下列条件的同分异构体有__________种。
①含2个苯环和2个羟基,且2个羟基不能连在同一个碳上
②与FeCl3溶液不能显紫色
③核磁共振氢谱显示有5组峰,峰面积比为1:2:2:2:1
(6)已知: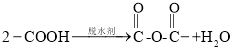 。以邻二甲苯和苯酚为原料合成酚酞(
。以邻二甲苯和苯酚为原料合成酚酞(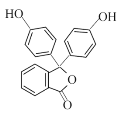 ),无机试剂任选,写出合成路线________________。(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
),无机试剂任选,写出合成路线________________。(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上可采用湿法技术从废印刷电路板中回收纯铜,其流程简图如下:
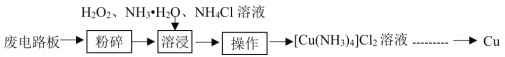
回答下列问题:
(1)开始时,将废电路板“粉碎”的目的是__________。“操作”的名称是_________________。
(2)某化学兴趣小组同学为探究“溶浸”过程中反应的实质,采用如图所示的装置,设计了如下对照实验。
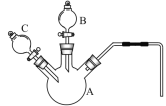
序号 | 实验名称 | 实验步骤 | 实验现象 | |
Ⅰ | 将铜片置于H2O2溶液中 | 先向A中加入0.5g光亮的铜片,再通过B加入30%的H2O2溶液 | —————— | 开始无明显现象,10小时后,溶液变为浅蓝色,铜表面附着一层蓝色固体 |
Ⅱ | 将铜片置于硫酸酸化的H2O2溶液中 | 再通过C加入8mL 5mol/L 的稀硫酸 | 开始铜片表面产生少量气泡,随着反应的进行,气泡越来越多,溶液颜色为蓝色,铜片表面保持光亮 | |
Ⅲ | 将铜片置于有氨水的H2O2溶液中 | 再快速通过C加入8mL 5mol/L的氨水 | 立即产生大量的气泡,溶液颜色变为深蓝色,铜片表面有一层蓝色固体附着,产生的气体能使带火星的木条复燃 | |
Ⅳ | 将铜片置于加有氨水和NH4Cl的H2O2溶液中 | 先向A中加入0.5g光亮的铜片和0.2g NH4Cl固体,再通过B加入30%的H2O2溶液 | 再快速通过C加入8mL 5mol/L的氨水 | 立即产生大量的气泡,______,铜片表面依然保持光亮 |
①仪器A的名称为______________________。
②实验Ⅰ中反应的化学方程式为___________________________。
③实验Ⅱ中产生的气体是________(写化学式),实验Ⅱ比实验Ⅰ/span>现象明显的原因是__________。
④实验Ⅲ中“溶液颜色变为深蓝色”所发生反应的离子方程式为________________。
⑤实验Ⅳ中空格处实验现象为__________,加入NH4Cl的作用是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铈及其化合物在工业生产中应用广泛。以某玻璃废料(主要成分为CeO2、SiO2、Fe2O3、FeO等)为原料制备CeO2和NH4Fe(SO4)2·12H2O(硫酸铁铵晶体),其流程如下(已知CeO2既不溶于稀硫酸,也不溶于氢氧化钠溶液):
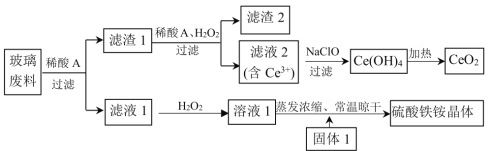
回答下列问题:
(1)浸取玻璃废料选用的“稀酸A”为____________(填“稀硫酸”或“稀盐酸”)。
(2)向滤渣1加入H2O2的目的是_________(用离子方程式表示)。为了提高溶解“滤渣1”的速率,常釆用加热措施,但温度高于60℃时溶解速率减慢,其主要原因是____________。
(3)为了不引入杂质,所选用固体1的化学式为_______________。
(4)制备2mol CeO2需要NaClO的质量为____________。
(5)锌铈液流电池放电时的工作原理如图所示。
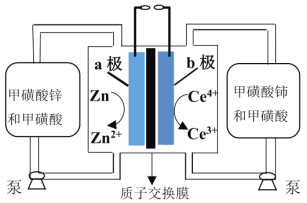
①放电时电池的总离子反应方程式为____________________。
②充电时,当a极增重6.5g时,有_________mol离子通过交换膜以平衡电荷。
查看答案和解析>>
科目: 来源: 题型:
【题目】近期我国学者研制出低成本的电解“水制氢”催化剂——镍掺杂的磷化钴三元纳米片电催化剂(![]() )。回答下列问题:
)。回答下列问题:
(1)Co在元素周期表中的位置为_________,Co2+价层电子排布式为______________。
(2)Co、Ni可形成![]() 、
、![]() 、
、![]() 等多种配合物。
等多种配合物。
①![]() 的空间构型为__________,
的空间构型为__________,![]() 中N原子的杂化轨道类型为_________。
中N原子的杂化轨道类型为_________。
②C、N、O、S四种元素中,第一电离能最大的是_____________。
③![]() 中含有σ键的数目为__________;已知NF3比NH3的沸点小得多,试解释原因________________________________________。
中含有σ键的数目为__________;已知NF3比NH3的沸点小得多,试解释原因________________________________________。
(3)常用丁二酮肟来检验Ni2+,反应如下:
Ni2+(aq)+2 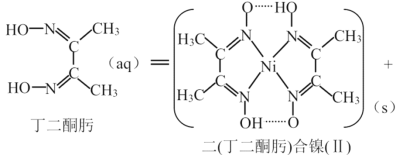 2H+(aq)
2H+(aq)
①1个二(丁二酮肟)合镍(Ⅱ)中含有_________________个配位键。
②上述反应的适宜![]() 为_________________(填字母序号)
为_________________(填字母序号)
A.12 B.5~10 C.1
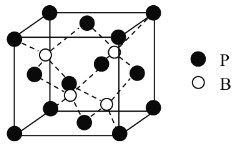
(4)磷化硼是一种备受关注的耐磨涂料,其晶体中磷原子作面心立方最密堆积,硼原子填入四面体空隙中(如图)。已知磷化硼晶体密度为![]() ,计算晶体中硼原子和磷原子的最近核间距为___________
,计算晶体中硼原子和磷原子的最近核间距为___________![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】在相同的密闭容器中,用高纯度纳米级Cu2O分别进行催化分解水的实验:2 H2O(g)![]() 2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:
2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:
序号 | 时间/min | 0 | 10 | 20 | 30 | 40 | 60 |
① | 温度T1 / 1号Cu2O | 0.0500 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | 温度T1 / 2号Cu2O | 0.0500 | 0.0490 | 0.0483 | 0.0480 | 0.0480 | 0.0480 |
③ | 温度T2 / 2号Cu2O | 0.0500 | 0.0480 | 0.0470 | 0.0470 | 0.0470 | 0.0470 |
下列说法不正确的是( )
A. 实验时的温度T2高于T1
B. 2号Cu2O的催化效率比1号Cu2O的催化效率高
C. 实验①前20 min的平均反应速率v(O2) = 7×10ˉ5 mol·Lˉ1·minˉ1
D. 等质量纳米级Cu2O比微米级Cu2O催化效率高,这与Cu2O的粒径大小有关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com