
科目: 来源: 题型:
【题目】2019年为“国际化学元素周期表年”。如图所示是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法不正确的是
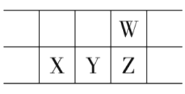
A.原子半径:W<X
B.气态氢化物热稳定性:Z<W
C.Y单质可用做半导体材料
D.X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目: 来源: 题型:
【题目】随着化工产业的迅猛发展,氯化氢转化为氯气的技术成为科学研究的热点。请按要求回答下列问题:
(1)HCl直接氧化法制Cl2可按下列催化过程进行:
CuCl2(s)=CuCl(s)+1/2Cl2(g) ΔH1 = +83 kJ·mol-1
CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH2 = -20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3 = -121 kJ·mol-1
写出HCl直接氧化法制Cl2的热化学方程式:____________________________。
(2)在恒定容器中用上述HCl直接氧化法制Cl2,进料c(HCl) ∶c(O2)分别为1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如下图所示:
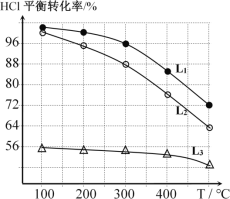
①判断图中c(HCl) /c(O2) = 1:1的曲线为________。
②按化学计量系数比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料时c(HCl)/c(O2)过低、过高的不利影响分别是____________、________。
③综合上述信息,写出在一定温度的条件下进一步提高HCl的转化率的方法: ________________________________________。
④观察上图,以任何一条曲线为例,平衡常数K(200℃)________K(300℃)(填“大于”、“小于”或“等于”)。
⑤设O2初始浓度为c,计算L2对应K(300℃) =____________(列出含c的计算式)。
(3)科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
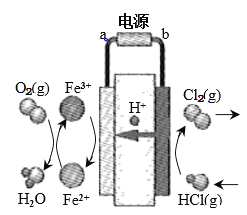
①电源b极为____________极。
②写出阳极区域反应方程式:________________________________________。
③电路中转移1 mol电子时,阳极产生气体体积为__________________L(标准状况)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于杂化轨道的叙述中不正确的是
A. 分子中心原子通过sp3杂化轨道成键时该分子不一定为正四面体结构,所以杂化轨道理论与VSEPR模型分析分子的空间构型结果常常相互矛盾
B. 杂化轨道用于形成σ键或用于容纳未参与成键的孤电子对
C. SF2和C2H6分子中的中心原子S和C都是通过sp3杂化轨道成键
D. 苯分子中所有碳原子均采取sp2杂化成键,苯环中存在6个碳原子共有的大π键
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法不正确的是
A. CH4、SF6、二氯乙烯(反式)、H2O2都是含极性键的非极性分子
B. 在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键
C. 酸性:H2CO3<H3PO4<HNO3<HClO4
D. CO的一种等电子体为NO+,它的电子式为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】制备水合肼(N2H4·H2O)的反应原理是CO(NH2)2+ 2NaOH + NaClO=Na2CO3+N2H4·H2O+NaCl。已知CO(NH2)2沸点:133 ℃;水合肼是重要化工原料,沸点:118 ℃,易被氧化。请按要求回答下列制备水合肼实验的有关问题。
(1)制备 NaClO 溶液(实验装置如图所示)

锥形瓶中发生反应离子方程式是__________________________。
(2)制取水合肼(实验装置如右图所示,夹持装置已略)
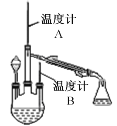
控制反应温度,再将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应后,加热蒸馏三颈烧瓶内的溶液,收集产品。
①分液漏斗中盛装的药品是NaOH溶液和_______________。
这样盛放的理由是防止___________________________________。
②本实验收集产品馏分时的关键条件是控制_______________________________。
(3)测定馏分中肼的含量。
①已知水合肼在一定条件下与I2反应生成N2,完成该反应原理的化学方程式:
____N2H4·H2O +____ I2 +6NaHCO3+H2SO4 = ____ N2↑+____ NaI +6CO2↑+Na2SO4 +7H2O
__________________________
②测定实验的步骤如下:
a.称取馏分 5.000 g,加水配制成1000 mL待测液溶液。
b.移取10.00 mL于锥形瓶中,加入10 mL水、稀硫酸、适量 NaHCO3固体(保证滴定过程中溶液的 pH 保持在 6.5左右)、2滴淀粉溶液,摇匀。
c.用0.2000 mol/L I2溶液滴定,至溶液呈现___________________________,记录消耗I2标准液的体积。
d._______________________________;然后处理数据。
③经数据处理,滴定消耗I2的标准溶液为 8.20 mL,馏分中水合肼(N2H4·H2O)的质量分数为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】药物阿佐昔芬F主要用于防治骨质疏松症等。其合成路线如下:
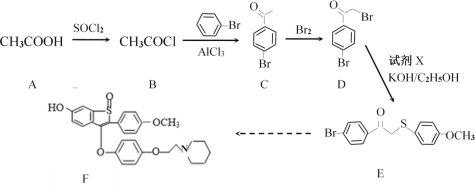
请按要求回答下列问题:
(1)A中最多共平面的原子数目:______;C中所含官能团名称:_______;C→D的反应类型______________。
(2)已知卤原子直接与苯环相连时碳卤键非常牢固,很难断键。写出D与NaOH水溶液加热条件下反应的化学方程式:________________________________________。
(3)试剂X的分子式为C7H8OS,写出X的结构简式:___________________。
(4)C的一种同分异构体M同时满足下列条件的所有可能的结构有(考虑顺反异构现象)_________种。
a.苯环上有两个取代基
b.能与FeCl3溶液发生显色反应
c.能使溴的四氯化碳溶液褪色
写出其中有4种不同化学环境氢原子的结构简式:_______________________。
(5)请写出以1-丙醇和氯苯为原料经四步制备 ![]() 的合成路线(其他试剂任选,合成路线示例见题干,有机物均写结构简式)。________。
的合成路线(其他试剂任选,合成路线示例见题干,有机物均写结构简式)。________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关微粒间作用力的说法正确的是
A. 硼酸[B(OH)3]晶体具有与石墨相似的层状结构,则分子中B原子发生的是sp3杂化,不同层分子间主要作用力是范德华力
B. 金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所以与共价键类似也有方向性和饱和性
C. 干冰气化和冰融化克服的分子间作用力相同
D. 离子晶体熔融状态电离过程中,只有离子键被破坏
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及铁的化合物在生活、生产中具有广泛应用,如亚铁氰化钾即K4[Fe(CN)6]是食盐中常用的抗结剂、铁基(氟掺杂镨氧铁砷化合物)是高温超导材料、“愚人金”是制备硫酸的主要矿物原料。请按要求回答下列问题。
(1)K4[Fe(CN)6]配合物中存在的作用力类型有__________________________(从“金属键”、“离子键”、“共价键”、“配位键”、“氢键”、“范德华力”中选填);其中CN-中各原子最外层均满足8电子稳定结构,其电子式为___________________,其中C原子的杂化形式是_____________。
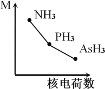
(2)铁基化合物中氟、氧、砷三种元素中电负性值由大到小的顺序是_____________(填元素符号)。其中氢化物(RH3)的某种性能(M)随R的核电荷数的变化趋势如图所示,则纵轴M可能表示为_____________________(从“沸点”、“稳定性”、“分子间作用力”、“R—H键能”中选填)。
(3)FeCl3晶体熔点为306 ℃,而FeF3晶体熔点高于1000 ℃,试解释两种化合物熔点差异较大的原因:____________________________________________。
(4)结合下表数据,所得结论:I1(Cu)<I1(Fe),而I2(Cu)>I2(Fe)。请用所学理论解释:________________________________________。

(5)“愚人金”是铁硫化合物,其晶体的晶胞如上右图所示。该晶体的化学式为______________。

查看答案和解析>>
科目: 来源: 题型:
【题目】关于乙炔分子中的共价键说法正确的是
A. sp杂化轨道形成σ键属于极性键,未杂化的2p轨道形成π键属于非极性键
B. C-H之间是sp-s形成σ键,与s-p σ键的对称性不同
C. (CN)2与乙炔都属于直线型分子,所以(CN)2分子中含有3个σ键和2个π键
D. 由于π键的键能比σ键的键能小,乙炔分子![]() 三键的键能小于C-C单键的键能的3倍,所以乙炔化学性质活泼易于发生加成反应
三键的键能小于C-C单键的键能的3倍,所以乙炔化学性质活泼易于发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com