
科目: 来源: 题型:
【题目】为了探究KI与FeCl3的反应为可逆反应,且有一定的限度,某化学小组进行了两组实验:
(1)请写出KI溶液与FeCl3溶液反应的离子反应方程式:______;
实验I:探究KI与FeCl3的反应为可逆反应
步骤1:设计如下图原电池装置,接通灵敏电流计,指针向左偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。
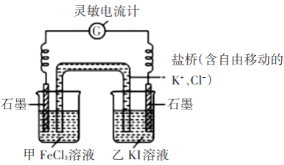
步骤2:当指针读数变零后,向甲中加入少量FeCl2固体,向乙中加入少量碘固体;
(2)若灵敏电流计出现_________(答现象),则证明该反应为可逆反应。实验结论:该反应为可逆反应。
(3)根据以上实验结论解释步骤1中“最后读数变为零”的原因_______;
(4)加入FeCl2和碘固体后,正极的电极反应式为______;
实验II:证明KI与FeCl3的反应有一定限度。
步骤3:取5 mL 0.1 mol/L的KI溶液于试管,滴加0.1 mol/L的FeCl3溶液2 mL,振荡;
步骤4:取少量反应后的溶液,向其中加入几滴淀粉溶液,充分振荡;
(5)观察到的现象是________;
步骤5:另取少量反应后的溶液,滴加0.1 mol/L的AgNO3溶液,振荡,产生黄色沉淀,则证明该反应有一定限度。
(6)但有同学认为步骤5现象不能证明得出的结论,原因是______,修正实验方案后得到结论:该反应有一定的限度。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是工业生产硝酸铵的流程。
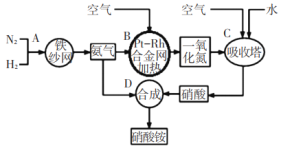
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式:_____。
(2)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为![]() ,此时H2的转化率为_____。
,此时H2的转化率为_____。
(3)设备B中反应的化学方程式为____。
(4)利用以上流程,若N2与H2合成氨时,H2的转化率如上题所求,氨气催化氧化制硝酸时损失20%,其他环节损失忽略不计,则9吨H2最多可制取_____吨硝酸铵。
(5)某课外小组运用原电池原理合成氨,其装置结构如图所示:
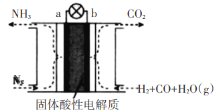
该装置的负极为_____(填a或b),试写出a极的电极反应式_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在酸性溶液中,碘酸钾(KIO3)和Na2SO3可发生如下反应:2![]() +5
+5![]() +2H+=I2+5
+2H+=I2+5![]() +H2O,生成的碘可以用淀粉溶液检验,根据溶液出现蓝色所需的时间来衡量该反应的速率。某学生设计实验如下表所示(表格中体积单位均为mL):
+H2O,生成的碘可以用淀粉溶液检验,根据溶液出现蓝色所需的时间来衡量该反应的速率。某学生设计实验如下表所示(表格中体积单位均为mL):
0.01mol/LKIO3溶液的体积 | 某浓度的Na2SO3溶液的体积 | H2O的体积 | 实验温度/℃ | 溶液出现蓝色所需时间 | |
实验1 | 5 | 5 | V1 | 0 | a |
实验2 | 5 | 5 | 20 | 25 | b |
实验3 | 5 | V2 | 15 | 25 | c |
(1)V1=______ mL,V2=______ mL。
(2)如果研究浓度对反应速率的影响,使用实验__________和实验__________。
(3)对比实验1和实验2,可以研究__________对化学反应速率的影响。
(4)溶液出现蓝色所需的时间从多到少的顺序是__________(用a、b、c表示)。
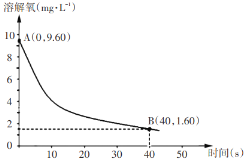
(5)已知反应:2Na2SO3(aq)+O2(aq)=2Na2SO4(aq)。在291.5K时,1.0 L溶液中Na2SO3初始量为10 mmol(1 mol=103 mmol),每5s记录一次溶解氧浓度,一段时间后实验结果如曲线,求0-40s内Na2SO
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分。
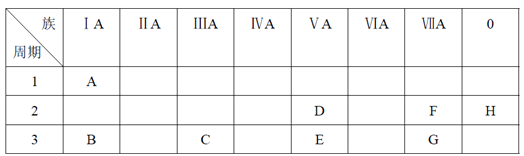
根据A~G元素在周期表中的位置,用化学式填写空白。
(1)氧化性最强的单质是______,还原性最强的单质是______,化学性质最不活泼的单质是______。(填相应的化学式)
(2)最稳定的氢化物是______。(填相应的化学式)
(3)一个E原子的核外电子总共有______种运动状态。
(4)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是_______。(填相应的化学式)
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中模拟用甲烷与氯气反应得到的副产品来制取盐酸,原理如图:
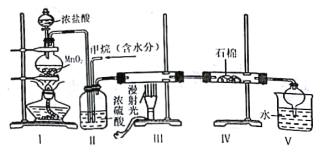
下列说法不正确的是
A.依据装管Ⅰ中的现象控制气流的速度
B.分离装置V中盐酸的最佳操作方法是分液
C.装置Ⅳ的石棉中可加入一些氢氧化钠粉末
D.实验过程中可观察到装置Ⅲ中硬质玻璃管内壁有附着的油珠
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物W是合成一种抗心律失常药物的中间物质,一种合成该物质的路线如下:

(1)ClCH2CH2C1的名称是____________。
(2)E中不含氧的官能团的名称为____________。
(3)C的分子式为__________,B→C的反应类型是____________。
(4)筛选C→D的最优反应条件(各组别条件得到的D的产率不同)如下表所示:
组别 | 加料温度 | 反应溶剂 | AlCl3的用量(摩尔当量) |
① | -30~0℃ |
| 1 eq |
② | -20~-10℃ |
| 1 eq |
③ | -20~-10℃ | ClCH2CH2Cl | 1 eq |
上述实验筛选了________和________对物质D产率的影响。此外还可以进一步探究___________对物质D产率的影响。
(5)M为A的同分异构体,写出满足下列条件的M的结构简式:__________________。
①除苯环外不含其他环;②有四种不同化学环境的氢,个数比为1:1:2:2;③1 mol M只能与1mol NaOH反应。
(6)结合上述合成路线,写出以![]() 、CH3I和SOCl2为基本原料合成
、CH3I和SOCl2为基本原料合成![]() 的路线图。(其他所需无机试剂及溶剂任选)
的路线图。(其他所需无机试剂及溶剂任选)
已知,RCOOH![]() RCOCl。
RCOCl。
____________________________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色溶液中可能含有H+、![]() 、K+、Mg2+、Fe3+、Al3+、Cl-、
、K+、Mg2+、Fe3+、Al3+、Cl-、![]() 、
、![]() 、
、![]() 中的几种离子,且几种阴离子浓度相同(不考虑水的电离)。取三份该溶液于三支试管中,每份10 mL,进行如下操作:
中的几种离子,且几种阴离子浓度相同(不考虑水的电离)。取三份该溶液于三支试管中,每份10 mL,进行如下操作:
①向试管1中滴加足量的BaCl2溶液,过滤后得到沉淀0.03 mol,向滤液中滴加AgNO3溶液有白色沉淀生成。
②向试管2中滴加一定浓度的NaOH溶液,产生沉淀的物质的量与NaOH溶液体积关系如图所示。
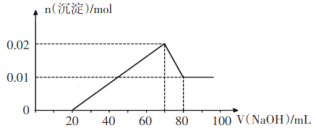
③向试管3中加入足量铜粉,铜粉溶解并产生无色气体,该气体在试管口处变为红棕色。
则下列说法中正确的是
A.该溶液中一定存在H+、K+、Mg2+、Al3+、Cl-、![]() 、
、![]()
B.该溶液中c(K+)一定为2 mol/L
C.试管2中滴加的NaOH溶液浓度一定为1 mol/L
D.试管3中溶解的铜粉质量一定为0.72 g
查看答案和解析>>
科目: 来源: 题型:
【题目】氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式___________________。

(2)已知:N2(g)+O2(g)=2 NO(g) △H=+178 kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g)△H=-743kJ·mol-1
则反应CO(g)+1/2O2(g)=CO2(g)的△H=_______kJ·mol-1
(3)在一固定容积为2L的密闭容器内加入1.5 mol的N2和5 mol的H2,在一定条件下发生如下反应:N2+3H2![]() 2NH3,若第5分钟时达到平衡,此时测得NH3的物质的量为2mol,则前5分钟的平均反应速率υ(N2)为_________,平衡时H2的转化率为_________,该反应的平衡常数K=__________。
2NH3,若第5分钟时达到平衡,此时测得NH3的物质的量为2mol,则前5分钟的平均反应速率υ(N2)为_________,平衡时H2的转化率为_________,该反应的平衡常数K=__________。
(4)在体积一定的密闭容器中能说明合成氨反应一定达到平衡状态的是_____;在压强一定的密闭容器中能说明合成氨反应一定达到平衡状态的是_____
a. 容器内N2、H2、NH3的浓度之比为1:3:2 b. NH3的浓度保持不变
c. 容器内压强保持不变 d. 混合气体的密度保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含![]() 废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
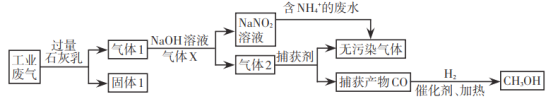
已知:1 mol CO和1 mol CH3OH分别完全燃烧生成CO2(g)和H2O(l),放出的热量为283.0kJ和726.5kJ。下列说法错误的是
A.固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B.气体X在流程中体现还原性
C.相同质量的CO和CH3OH完全燃烧,后者放出的热量多
D.处理含![]() 废水时,发生反应的离子方程式为:
废水时,发生反应的离子方程式为:![]() +
+![]() =N2↑+2H2O
=N2↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】钛的化合物如TiO2、Ti(NO3)4、TiCl4、Ti(BH4)2等均有着广泛用途。
(1)写出Ti的基态原子的外围电子排布式_____。
(2)TiCl4熔点是﹣25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于_____晶体;BH4﹣中B原子的杂化类型为_____。
(3)在 TiO2催化作用下,可将CN﹣氧化成CNO﹣,进而得到N2。与CNO﹣互为等电子体的分子化学式为(只写一种)________。
(4)Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2H2O(绿色)。绿色晶体中配体是_______。

(5)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为______。
(6)金属钛内部原子的堆积方式是面心立方堆积方式,如图2。若该晶胞的密度为ρgcm﹣3,阿伏加德罗常数为NA,则该晶胞的边长为___cm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com