
科目: 来源: 题型:
【题目】把过量铁屑加入FeCl3、CuCl2的混合溶液中,反应结束后,称得剩余固体的质量与所加铁屑的质量相等。则原溶液中FeCl3与CuCl2的物质的量之比是( )
A.7∶2B.3∶2
C.2∶3D.2∶7
【答案】D
【解析】
根据反应①2Fe3++Fe=3Fe2+可知,铁溶解,固体质量减少,根据反应②Cu2++Fe=Cu+Fe2+可知,铁溶解,铜析出,固体质量增加,而反应结束后,称得剩余固体质量与所加铁屑的质量相等,则反应①中固体减少的质量与反应②中固体增加的质量相等,即56 g·mol-1×![]() =(64g·mol-1-56g·mol-1)×n(Cu2+),得n(Fe3+)∶n(Cu2+)=2∶7,故n(FeCl3)∶n(CuCl2)=2∶7,故答案为D。
=(64g·mol-1-56g·mol-1)×n(Cu2+),得n(Fe3+)∶n(Cu2+)=2∶7,故n(FeCl3)∶n(CuCl2)=2∶7,故答案为D。
【点睛】
考查Fe3+、Cu2+的氧化能力大小的比较,能正确判断固体的成分是解本题的关键;根据Fe3+、Cu2+的氧化性强弱判断反应先后顺序,从而确定固体的成分、溶液的成分;有固体剩余,若固体只有铜,则反应后的溶液中一定无Fe3+存在,一定存在Fe2+,可能含有Cu2+;若有铁剩余,一定有铜生成,Fe3+和Cu2+无剩余。
【题型】单选题
【结束】
7
【题目】下列说法正确的是( )
A.绿矾是含有一定量结晶水的硫酸亚铁,在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:样品中没有Fe3+,Fe2+易被空气氧化为Fe3+
B.在给定条件下,Fe![]() FeCl2
FeCl2![]() Fe(OH)2可以实现
Fe(OH)2可以实现
C.Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3
D.铁比铜金属性强,故用FeCl3溶液腐蚀印刷电路板上的铜
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 铁与FeCl3溶液反应:Fe+Fe3+===2Fe2+
B. Fe与稀盐酸反应:2Fe+6H+===2Fe3++3H2↑
C. FeCl2溶液与Cl2反应:Fe2++Cl2===Fe3++2Cl-
D. Fe(OH)3与盐酸反应:Fe(OH)3+3H+===Fe3++3H2O
【答案】D
【解析】A、电荷不守恒,应为Fe+2Fe3+=3Fe2+,故A错误;B、违反反应事实,应为Fe+2H+=Fe2++H2↑,故B错误;C、电荷不守恒,应为2Fe2++Cl2=2Fe3++2Cl-,故C错误;D、氢氧化铁是难溶物质,不能拆写成离子,发生中和反应,故D正确。
点睛:离子反应方程式正误判断中,一先看是否符合客观事实,二看电荷数是否相等,三看拆写是否正确,四看是否缺少反应。
【题型】单选题
【结束】
6
【题目】把过量铁屑加入FeCl3、CuCl2的混合溶液中,反应结束后,称得剩余固体的质量与所加铁屑的质量相等。则原溶液中FeCl3与CuCl2的物质的量之比是( )
A.7∶2B.3∶2
C.2∶3D.2∶7
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如图所示,用CuSi合金作硅源,在950℃利用三层液熔盐进行电解精炼,下列说法正确的是( )
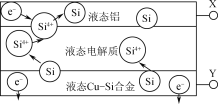
A.X与电源的正极相连
B.电子能够在三层液熔盐间自由流动
C.电子由液态CuSi合金流出
D.在该液相熔体中Cu优先于Si被氧化,Si4+优先于Cu2+被还原
查看答案和解析>>
科目: 来源: 题型:
【题目】早在古代,我国人民就积累了不少对化学物质变化的认识。例如,晋代炼丹家、医学家葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这句话中的丹砂指的是HgS,下列有关说法正确的是( )
A.这个过程只涉及物理变化
B.“积变又还成丹砂”过程中发生反应:HgS![]() Hg+S
Hg+S
C.实验室中不慎洒落的水银不能用硫黄处理
D.“丹砂烧之成水银”过程中还可能产生SO2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图像与描述相符的是( )
A.图1是C(s)+H2O(g)![]() CO(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0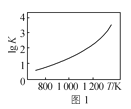
B.图2表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化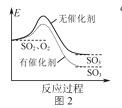
C.图3是室温下AgCl和AgI的饱和溶液中离子浓度的关系曲线,说明该温度下反应AgCl(s)+I-(aq)![]() AgI(s)+Cl-(aq)的平衡常数K=2.5×106
AgI(s)+Cl-(aq)的平衡常数K=2.5×106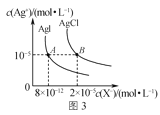
D.图4表示向BaCl2溶液中滴加稀硫酸至过量的过程中溶液导电性的变化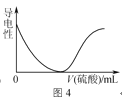
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子组在指定溶液中能大量共存的是
A. 常温下,c(H+)/c(OH)=1×1012的溶液:K+、AlO2、CO32、Na+
B. 加入苯酚显紫色的溶液:K+、NH4+、Cl、I
C. 加入Al能放出大量H2的溶液中:NH4+、Na+、NO3、SO42
D. 常温下,pH=7的溶液:Cu2+、Fe3+、NO3、SO42
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.Al2O3溶于NaOH溶液:Al2O3+2OH-=2AlO2-+2H2O
B.AgNO3溶液中加入过量氨水:Ag++NH3·H2O=AgOH↓+NH4+
C.用惰性电极电解0.1mol·L-1CuCl2溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
D.过量NaHCO3溶液和澄清石灰水混合:Ca2++HCO![]() +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。回答下列有关氧化还原的问题。
Ⅰ.氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-→NO+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)物质(甲)为_________。(填化学式)
(2)反应中若产生标况下4.48LNO气体,则转移电子的数目是 ____________。
Ⅱ.亚硝酸钠(NaNO2)像食盐一样有咸味,但有很强的毒性,误食NaNO2会使人中毒。已知亚硝酸钠能发生如下反应:2NaNO2 + 4HI ═ 2NO↑ + 2NaI + I2 + 2H2O
(1)用双线桥标出该反应的电子转移方向及数目:_______。氧化剂与还原剂的物质的量之比为______。
(2)测定NaNO2的质量分数的过程如下:称取NaNO2粗品0.6 g于锥形瓶中,先加水溶解,再向其中滴加0.1 mol·L-1酸性KMnO4溶液,恰好完全反应时,消耗酸性KMnO4溶液24mL。计算装置C中所得固体中NaNO2的质量分数___________。(已知测定过程中发生反应的方程式为MnO4-+NO2-+H+—Mn2++NO3-+H2O(未配平),且杂质不与KMnO4反应)
(3)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出两种方案。
①方案a:微碱性条件下用Fe(OH)2还原NO3-,产物为NH3。生成3.4g NH3同时会生成_____molFe(OH)3。
②方案b:碱性条件下用Al粉还原NO3-,产物是N2。发生的反应可表示如下,完成方程式并配平。
____Al+____NO3-+____ (____)—____AlO2-+______N2↑+____(____)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、钴、镍及化合物在机械制造、磁性材料、新型电池或高效催化剂等许多领域都有着广泛的应用。请回答下列问题:
(1)基态Ni原子核外的最高能层符号是______,基态Ni2+最外层电子排布式为_______,未成对电子数为________________。
(2)[Co(NO![]() )4]2–中各元素的第一电离能由小到大的顺序为______(填元素符号),配体中N的杂化方式为______________。
)4]2–中各元素的第一电离能由小到大的顺序为______(填元素符号),配体中N的杂化方式为______________。
(3)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如图所示:
①上述三种晶体的晶胞中属于体心立方晶胞的是______(填“α”“δ”或“γ”)-Fe。
②γ-Fe晶胞中铁原子的配位数为_______________。
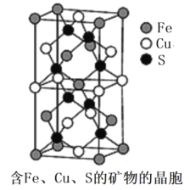
(4)一种含有Fe、Cu、S 三种元素的矿物的晶胞(如图所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为_________。若晶胞的底面边长为Apm,高为C pm,阿伏伽德罗常数为NA,则该晶体的密度为__________g/cm3(写出表达式)。
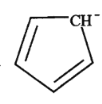
(5)二茂铁[(C5H5)2Fe]可用作火箭燃料添加剂、汽油抗爆剂。二茂铁熔点172℃,沸点249℃,易升华,难溶于水,易溶于有机溶剂,它属于__________晶体。分子中的大π键可用符号![]() 表示,其m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,环戊二烯负离子(C5H
表示,其m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,环戊二烯负离子(C5H![]() )结构如图所示,其中的大π键可以表示为_______。
)结构如图所示,其中的大π键可以表示为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com