
科目: 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g) + O2(g) △H >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g) + O2(g) △H >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A.500 s内NO2的生成速率为2.96×10-3mol·L-1·s-1
B.T1温度下该反应平衡时N2O5的转化率为29.6%
C.达到平衡后,其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)﹤5.00mol/L
D.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语对事实的表述正确的是
A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B.向 Na2SiO3溶液中通入过量的SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32-
C.由 Na 和 C1 形成离子键的过程:![]()
D.NaHSO4熔融电离:NaHSO4![]() Na++H++SO42-
Na++H++SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是硫酸试剂瓶标签上的部分内容。据此下列说法中正确的是( )
硫酸 化学纯CP
500 mL
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g·cm-3
质量分数:98%
A.该硫酸可以用来干燥硫化氢气体
B.1molZn与足量的该硫酸反应能产生2gH2
C.配制250mL4.6mol·L-1的稀硫酸需取该硫酸62.5mL
D.若不小心将该硫酸溅到皮肤上,应立即用NaOH溶液冲洗
查看答案和解析>>
科目: 来源: 题型:
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是_____,X和Y中电负性较大的是__(填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是_________(填离子符号)。
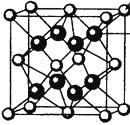
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某废液中含有 大量 的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴,(Br2常温下是深红棕色液体),设计了如下的流程图:

可供选择的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2 溶液(H+)、KMnO4溶液(H+)、盐酸。请根据流程图回答相关问题 :
(1)若试剂a为H2O2溶液(H+),已知H2O2+2KBr+2HCl=Br2+2H2O+2KCl,
①发生反应的离子方程式为:___________。
②每消耗0.2mol H2O2,反应转移的电子数为_______mol。
③还原剂和还原产物的物质的量之比是_____________。
(2)操作①②③④⑤对应的名称分别是:萃取、_________、蒸馏、过滤、__________。蒸馏过程用到下图装置的名称是A____________ B____________。

(3)为了除去无色液体中的Ca2+、Mg2+、SO42-,从可供选则试剂中选择试剂b所代表的物质,按照滴加的顺序依次是_______、_________、_________(填化学式)。
(4)调节pH=7是为了除去杂质离子_______和________,以提高氯化钾晶体的纯度。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如如:
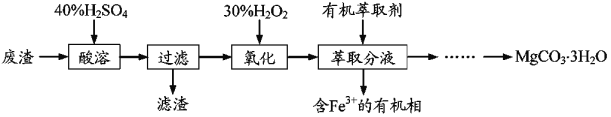
(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)=Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4kJ·mol–1
Mg2SiO4(s)+4H+(aq)=2Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4kJ·mol–1
酸溶需加热的目的是__;所加H2SO4不宜过量太多的原因是__。
(2)加入H2O2氧化时发生发应的离子方程式为__。
(3)用如图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。
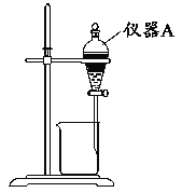
①实验装置图中仪器A的名称为__。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,__、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,___,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,实验室制取高铁酸钠的化学方程式如下 :
(1)请用双线桥法表达出此反应的电子转移情况:__________
2Fe( NO3 )3+16NaOH+3Cl2=2Na2FeO4+6NaNO3 +6NaCl+8H2O
(2)若要制取8.3g高铁酸钠需要标准下Cl2的体积为多少?______若所用氢氧化钠溶液体积为200mL,则氢氧化钠溶液的物质的量浓度是多少?(写出计算过程)_______
查看答案和解析>>
科目: 来源: 题型:
【题目】在电解液不参与反应的情况下,采用电化学法还原CO2可制备ZnC2O4,原理如图所示。下列说法正确的是
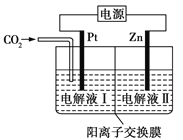
A. 电解结束后电解液Ⅱ中c(Zn2+)增大
B. 电解液Ⅰ应为ZnSO4溶液
C. Pt极反应式为2CO2+2e=![]()
D. 当通入44 g CO2时,溶液中转移1 mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,pH均为2、体积均为V0的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随lg![]() 的变化关系如图所示,下列叙述错误的是( )
的变化关系如图所示,下列叙述错误的是( )
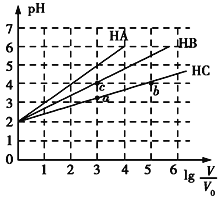
A. 常温下:Ka(HB)>Ka(HC)
B. HC的电离度:a点<b点
C. 当lg![]() =4时,三种溶液同时升高温度,
=4时,三种溶液同时升高温度,![]() 减小
减小
D. 当lg![]() =5时,HA溶液的pH为7
=5时,HA溶液的pH为7
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
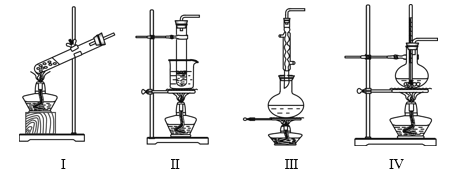
选项 | 实验目的 | 反应试剂及所需物质 | 选择装置 |
A | 制乙酸乙酯 | 无水乙醇、冰醋酸、浓硫酸、碎瓷片 | Ⅰ |
B | 进行银镜实验 | 银氨溶液、乙醛 | Ⅱ |
C | 制葡萄糖酸 | 葡萄糖、3%溴水 | Ⅲ |
D | 制乙烯 | 无水乙醇、浓硫酸、碎瓷片 | Ⅳ |
[注:葡萄糖与3%溴水在55 ℃左右反应]
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com