
科目: 来源: 题型:
【题目】25℃时,取0.l molL-1 HA溶液与0.1 molL-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=9,试回答以下问题:
(1)混合溶液的pH=9的原因_____________________(用离子方程式表示)。
(2)混合溶液中由水电离出的c(OH-) =______molL-1 ,0.1 molL-1NaOH 溶液中由水电离出的c(OH-) =______molL-1 。
(3)0.l molL-1 HA溶液与0.05 molL-1 NaOH溶液等体积混合后,pH=8,则
① 所得混合液中c(HA)、c(A-)、c(Na+)、c(OH-)、c(H+) 浓度从大到小的顺序为:_________________。
② c(HA)+ c(A-)=_______ molL-1,c(HA)-c(A-)=_______molL-1。
(4)25℃时,已知NH4A溶液为中性,将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的 pH________7(填“>”、“<”或“=”)。
(5)相同温度下相同物质的量浓度的下列四种盐溶液,pH由大到小的顺序____(填字母)。
A.NH4HCO3 B.NH4HSO4 C.NH4A D.NH4Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】山梨醇[CH2OH(CHOH)4CH2OH]可用作牙膏、食品的水分保持剂。其生产路线如下图所示。下列说法错误的是
![]()
A.活性炭脱色的过程为物理变化
B.加压氢化时葡萄糖中醛基转化为羟基
C.离子交换时可选用阴离子交换树脂
D.山梨醇可作水分保持剂是因为能与水形成氢键
查看答案和解析>>
科目: 来源: 题型:
【题目】欲用98%的浓硫酸(g=1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)选用的主要仪器有:
①__________,②__________,③__________,④____________,⑤____________。
(2)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4 |
B.反复颠倒摇匀 |
C.用胶头滴管加蒸馏水至刻度线 |
D.洗净所用仪器 |
E.稀释浓H2SO4
F.将溶液转入容量瓶
其操作正确的顺序依次为______________________。
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
②如果实验室有15mL、20mL、50mL的量筒应选用____________mL的量筒最好,量取时发现量筒不干净用水洗净后直接量取将使浓度__________(“偏高”、“偏低”、“无影响”)
③将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是____________,若搅拌过程中有液体溅出结果会使浓度偏____________。
④在转入容量瓶前烧杯中液体应____________,否则会使浓度偏____________;并洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,否则会使浓度____________。
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度____________;仰视则使浓度___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题
(1)等pH、等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是_____(填写序号)。
①开始反应时的速率A>B ②参加反应的锌的物质的量A=B
③反应所需要的时间B>A ④A中有锌剩余
(2)已知,CH3COOH是常见的弱酸,现有常温下0.1molL-1的CH3COOH溶液。
①温度不变,加水稀释过程中,下列表达式的数据一定变小的是_____(填字母序号,下同),②若该溶液升高温度,下列表达式的数据增大的是_____。
A.c(H+) B.c(H+)·c(OH-)
C.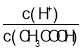 D.
D.![]()
(3)取0.10mol CH3COOH(冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):
① n(H+):a_____b;
② c(CH3COO-):a_____b;
③完全中和时消耗NaOH的物质的量:a_____b;
(4)25℃时,部分物质的电离平衡常数如下表所示:
CH3COOH | H2CO3 | HCN |
1.7×10﹣5 | K1=4.3×10-7 K2=5.6×10﹣11 | 4.9×10﹣10 |
请回答下列问题:
① CH3COOH、H2CO3、HCN的酸性由强到弱的顺序为_________。
② 焦炉煤气中一般含有H2S和HCN气体,有的工厂在真空条件下,使用K2CO3溶液吸收煤气中的H2S和HCN气体,实现脱硫脱氰。请根据上述数据,尝试从理论上推测同为0.l molL-1的K2CO3溶液和HCN混合后,最可能发生的反应的离子方程式_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下列物质在水溶液中的电离方程式:
HCl:____________________;Ca(OH)2:_________________;
NH3·H2O:_________________;NH4NO3:_________________;
H2CO3:______________________;
查看答案和解析>>
科目: 来源: 题型:
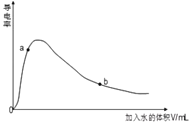
【题目】磷酸氯喹是一种抗疟疾药物,研究表明该药物对新型冠状病毒2019-nCOV有较好抑制作用,以下是该药物主体氯喹的合成路线。
已知:①![]() 具有芳香性;
具有芳香性;
②R1-Cl+H2N-R2 → R1-NH-R2+HCl
请回答:
(1)下列说法不正确的是_________
A.氯喹具有弱碱性 B.氯喹的分子式为C18H24N3Cl
C.整个合成过程中包含了取代、加成反应 D.1molB最多可以消耗3molNaOH
(2)请写出A转化成B的化学方程式_________
(3)A转化成B的过程中还会生成一种双六元环副产物,其结构简式为_________
(4)请利用乙烯为原料将合成路线中C→D部分补充完整,用线路图表示出来(无机试剂任选)_________
(5)请写出满足下列条件的![]() 的同分异构体_________
的同分异构体_________
①1HNMR谱显示分子中只存在两种H;②分子内只存在一个环结构
查看答案和解析>>
科目: 来源: 题型:
【题目】
(1)25 ℃下,0.1mol/L氨水的电离度为1%,则此温下,该溶液的pH=______。
(2)25 ℃下,pH=2的硫酸溶液Va mL与pH=10的NaOH溶液Vb mL恰好中和,则,Va:Vb=___________。
(3)某温下,水的离子积常数KW=1.0×10-13。该温下,0.2mol·L-1的NaHSO4溶液与0.2mol·L-1的Ba(OH)2溶液等体积混合,混合后溶液的pH=______。
(4)一定条件下,可逆反应A2(g)+B2(g)2AB(g)达到化学平衡,经测定平衡时c(A2)=0.5 mol·L-1,c(B2)=0.1 mol.L-1,c(AB)=1.4 mol·L-1,若A2、B2、AB的起始浓度分别以a、b、c表示。请回答:
①a、b应满足的关系是_________。
②a的取值范围是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在三个容积相同的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下发生反应CH4(g)+H2O(g)CO(g)+3H2(g)(不发生其他反应),CH4的平衡转化率与温度、压强的关系如右下图所示。
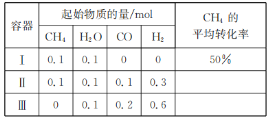
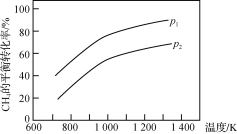
下列说法错误的是
A. 该反应的ΔH>0,图中压强P1>P2
B. 起始时,容器Ⅱ中v(CH4)正<v(CH4)逆
C. 达到平衡时,容器Ⅰ、Ⅱ中CO的物质的量满足:n(CO)Ⅱ<2n(CO)Ⅰ
D. 达到平衡时,容器Ⅱ、Ⅲ中气体的总压强之比:pⅡ∶pⅢ=4∶5
查看答案和解析>>
科目: 来源: 题型:
【题目】现有mg某X2气体,它的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)一个X原子的质量_________g。
(3)该气体在标准状况下的体积为________L。
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为________mol·L-1。
(5)该气体溶于1L水中(不考虑反应),所得溶液的密度为ρg/cm3,则该溶液的物质的量浓度为__________mol·L-1。
(6)相同状况下,若X2与氮气以体积比1:4混合,该混合气体相对氢气密度为14.4,X2的相对分子质量为_______。
(7)若标况下X2的密度为1.25 g/L,X原子最外层有_____个电子。
查看答案和解析>>
科目: 来源: 题型:
【题目】乳酸亚铁晶体〔CH3CH(OH)COO〕2Fe·2H2O是一种很好的食品铁强化剂,可由乳酸钙与FeCl2反应制得,制备流程如下:
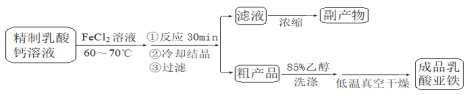
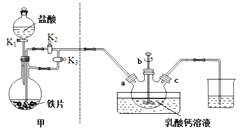
反应装置如下图所示:
已知:①潮湿的乳酸亚铁易被氧化
②物质的溶解性:
乳酸钙:溶于冷水,易溶于热水;乳酸亚铁:溶于冷水和热水,难溶于乙醇。
请回答:
(1)装置甲的气密性检查操作为_________
(2)部分实验操作过程如下,请按正确操作顺序填入字母,其正确的操作顺序是:检查气密性![]() 按图示要求加入试剂
按图示要求加入试剂![]() 将三颈烧瓶置于水浴中
将三颈烧瓶置于水浴中![]() (____)
(____)![]() (____)
(____)![]() (____)
(____)![]() (____)
(____)![]() (____)
(____)![]() (____)
(____)![]() 开动搅拌器
开动搅拌器![]() ……
……
a.关闭K1;
b.盖上分液漏斗上口玻璃塞;
c.关闭K3,打开K2;
d.关闭K2,打开K3;
e.打开分液漏斗上口玻璃塞;
f打开K1
(3)该装置制备乳酸亚铁的优点是_________副产物为_________
(4)下列说法正确的是_________
A.装置甲中的主要仪器是球形分液漏斗和蒸馏烧瓶
B.本实验采用较大铁片而不是铁粉的主要原因是控制反应速率,防止进入三颈烧瓶的氯化亚铁过多,反应过于剧烈
C.乳酸亚铁悬浊液应从b口倒出进行抽滤,并用滤液洗涤三颈烧瓶,将洗涤液倒入布氏漏斗再次抽滤
D.粗产品的洗涤液,经蒸馏后所得的残留液,与滤液混合可提高副产物的产量
(5)在实验过程中FeCl2溶液和乳酸钙溶液混合即出现浑浊,继续在60℃-70℃下反应30分钟,静置冷却、抽滤、洗涤、低温真空干燥,得到成品,经测定得到反应温度和成品中Fe3+含量关系如图,60℃之后Fe3+含量明显较低的可能的原因是_________
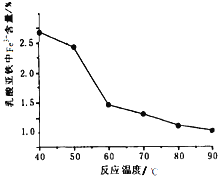
(6)有同学提出可直接用KMnO4滴定法测定样品中的Fe2+量进而计算纯度,但实验后发现结果总是大于100%,其主要原因可能是_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com