
科目: 来源: 题型:
【题目】根据所给出的装置图回答下列问题:
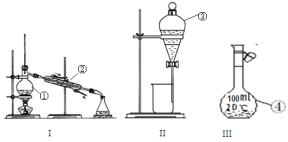
(1)①~④中,使用前必须检查是否漏水的是____________(填仪器序号)。
(2)分离溴水中的溴应先选择装置_____(填Ⅰ、Ⅱ、Ⅲ或Ⅳ序号,下同),进行操作A_______(填操作名称,下同);再选装置_____,进行操作B________;操作A需在溴水中加一种试剂,选择这一试剂时,下列性质你认为哪些是必需的:_______(填字母)。
A. 常温下为液态 B. Br2在其中溶解程度小 C. 与水互不相溶
D. 密度比水大 E. 与Br2不反应 F. 溶解Br2后呈现橙红色
查看答案和解析>>
科目: 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中,2 mol NO 和 1 mol O2 反应后分子总数为 2NA
B.标准状况下,7.8 g 乙炔和苯的混合物中含 C—H 键数目为 0.6NA
C.将 1 mol NH3 通入足量水中,NH3·H2O、NH4+粒子数目之和为 NA
D.1 L 0.1 mol·L1 FeCl3 溶液中含 Fe3+数目为 0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】4 ℃下,把质量A g摩尔质量为M g·mol-1的可溶性盐RCln 溶解在V mL水中,恰好形成该温度下的饱和溶液,密度为ρ g·cm-3,下列关系式错误的是
A. 溶质的质量分数ω=A/(A+V)×100%
B. 溶质的物质的量浓度c=1 000ρ A/(MA+MV) mol·L-1
C. 该温度下此盐的溶解度S=100A/V g
D. 1 mL该溶液中n(Cl-)=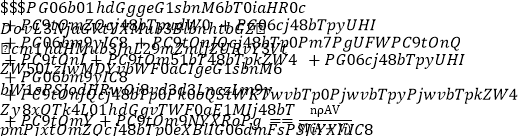 mol
mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语正确的是( )
A. (NH4)2 Fe(SO4)2 溶解于水:(NH4)2 Fe(SO4)2 =NH4+ + Fe2 + + 2SO42-
B. Al(OH)3在水中的电离:Al(OH)3 ![]() Al3 ++3OH-
Al3 ++3OH-
C. H3PO4溶解于水:H3PO4 ![]() 3H+ + PO43-
3H+ + PO43-
D. NaHSO4在水中的电离:NaHSO4 = Na+ + NaHSO4-
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物I是合成含六元环甾类化合物的一种中间体。利用Robinson成环反应合成I的路线如下,回答下列问题:

已知:①![]()
②
(1)B→C的反应方程式为________。
(2)化合物E和I的结构简式分别是________、________。
(3)C→D和F→G的反应类型分别是________、________。
(4)写出符合下列条件的G的同分异构体的结构简式________。
①与氢氧化钠完全反应时,二者物质的量之比为1:3;②有4种不同化学环境的氢。
(5)写出以甲醇、苯甲酸、乙酸甲酯和![]() 为原料合成
为原料合成 的合成路线(其它试剂任选)。______________________________________。
的合成路线(其它试剂任选)。______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】探索氮氧化合物反应的特征及机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
(1)工业上利用Na2CO3溶液吸收NO、NO2混合气制备NaNO2,该反应可实现NO和NO2的完全转化,反应的化学方程式为________。
(2)NO2可发生二聚反应生成N2O4,化学方程式为![]() ,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的
,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的![]() ________0(填>或<)。已知该反应的正反应速率方程为υ正= k正·c2(NO2),逆反应速率方程为υ逆=k逆·c(N2O4),其中k正、k逆分别为正、逆反应的速率常数。则图(lgk表示速率常数的对数;
________0(填>或<)。已知该反应的正反应速率方程为υ正= k正·c2(NO2),逆反应速率方程为υ逆=k逆·c(N2O4),其中k正、k逆分别为正、逆反应的速率常数。则图(lgk表示速率常数的对数; ![]() 表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随变化关系的是斜线________,能表示lgk逆随
表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随变化关系的是斜线________,能表示lgk逆随![]() 变化关系的是斜线________。
变化关系的是斜线________。
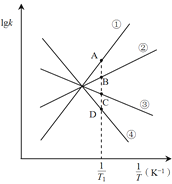
(3)图中A、B、C、D点的纵坐标分别为a + 1.5、a+0.5、a-0.5、a-1.5,则温度T1时化学平衡常数K=_______mol-1·L。已知温度T1时,某时刻恒容密闭容器中NO2、N2O4浓度均为0.2 mol·L-1,此时υ正________υ逆(填>或<);上述反应达到平衡后,继续通入一定量的NO2,则NO2的平衡转化率将________,NO2的平衡浓度将________(填增大、减小或不变)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是( )
A. 由H和Cl形成共价键的过程:![]()
B. Na2O2用于呼吸面具的供氧剂:2Na2O2+2CO2=2Na2CO3+O2
C. 实验室用NH4Cl和Ca(OH)2的混合物制取氨:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
D. 惰性电极电解饱和食盐水的离子方程式:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
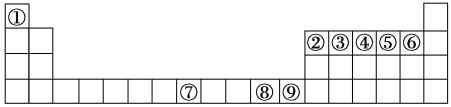
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表的______________区。
(2)②、⑥两元素形成的化合物的空间构型为______________,其中心原子的杂化轨道类型为________。
(3)写出元素③与元素⑤形成的稳定化合物的结构式_______________。
(4)⑧的二价阳离子与过量的④的氢化物的水化物作用的离子方程式为:______。
(5)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于________晶体(填晶体类型)。
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为________。
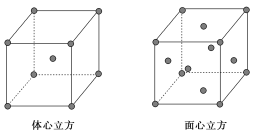
(7)金属⑦的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】水是自然界中普遍存在的一种物质,也是维持生命活动所必需的一种物质。
信息一:水的性质存在许多反常现象,如固态密度小于液态密度使冰浮在水面上,沸点相对较高使水在常温常压下呈液态等。
信息二:在20 ℃、1个大气压下,水可以结成冰,称为“热冰”(如下图):
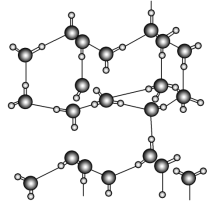
试根据以上信息回答下列问题:
(1)s轨道与s轨道重叠形成的共价键可用符号表示为ds-s,p轨道以“头碰头”方式重叠形成的共价键可用符号表示为dp-p,则H2O分子中含有的共价键用符号表示为________。
(2)下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用类型完全相同的是________。
A 金刚石 B 干冰 C 食盐 D 固态氨
(3)已知:2H2O=H3O++OH-,H3O+的立体构型是________,H3O+中含有一种特殊的共价键是________。
(4)根据等电子原理,写出短周期元素原子形成的与H3O+互为等电子体的分子或离子________。
(5)水的分解温度远高于其沸点的原因是________________。
(6)从结构的角度分析固态水(冰)的密度小于液态水的密度的原因是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用钒钛磁铁矿冶炼后产生的钒渣(主要含FeO·V2O3、Al2O3、SiO2及少量可溶性磷酸盐)生产V2O5的工艺流程如下,回答下列问题:
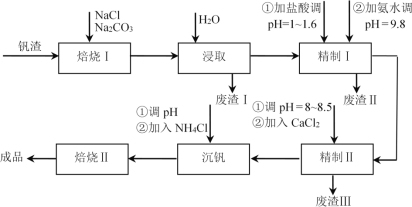
已知:①V2O5、Al2O3、SiO2可与Na2CO3、NaCl组成的混合钠盐在高温下反应,并转化为NaVO3、NaAlO2、Na2SiO3等可溶性钠盐。
②AlO![]() +4H+=Al3++2H2O。
+4H+=Al3++2H2O。
(1)焙烧Ⅰ包括氧化和钠化成盐两个过程,氧化的目的是获得V2O5,写出氧化过程中FeO·V2O3发生反应的化学方程式________;废渣Ⅰ的主要成分是________;精制Ⅰ中加盐酸调pH的主要作用是________,加入NH3·H2O后发生反应的离子方程式为________。
(2)精制Ⅱ中加入CaCl2溶液除去磷酸盐,pH过小时影响除磷效果的原因是________;pH过大时,沉淀量增大的原因是________。
(3)沉钒所得NH4VO3沉淀需进行洗涤,洗涤时除去的阴离子主要是________。NH4VO3在500℃时焙烧脱氨制得产品V2O5,反应方程式为2NH4VO3![]() V2O5+H2O↑+2NH3↑。但脱氨过程中,部分V2O5会转化成V2O4,反应中氧化剂与还原剂物质的量之比为3:2,该反应的化学方程式为________。
V2O5+H2O↑+2NH3↑。但脱氨过程中,部分V2O5会转化成V2O4,反应中氧化剂与还原剂物质的量之比为3:2,该反应的化学方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com