
科目: 来源: 题型:
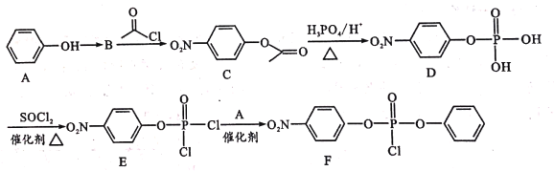
【题目】据研究报道,药物瑞德西韦(Remdesivir)对2019年新型冠状病毒(COVID-19)有明显抑制作用。F为药物合成的中间体,其合成路线如下:
已知:R-OH![]() R-Cl
R-Cl
(1)A中官能团名称是________;C的分子式为_____
(2)A到B为硝化反应,则B的结构简式为___,A到B的反应条件是_____。
(3)B到C、D到E的反应类型 ________(填“相同”或“不相同”);E→F的化学方程式为________ 。
(4)H是C的同分异构体,满足下列条件的同分异构体有_____种。
①硝基直接连在苯环上
②核磁共振氢谱峰面积之比为2:2:2:1
③遇FeCl3溶液显紫色
(5)参照F的合成路线图,设计由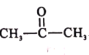 、SOCl2为原料制备
、SOCl2为原料制备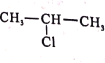 的合成路线_______(无机试剂任选)。
的合成路线_______(无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
A. 向稀盐酸中逐滴加入过量的![]() 溶液
溶液
B. 向![]() 溶液中逐滴加入过量稀
溶液中逐滴加入过量稀![]() 溶液
溶液
C. 向![]() 溶液中逐滴加入稀氨水
溶液中逐滴加入稀氨水
D. 向氢氧化钡溶液中通入过量![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)是二氧化氯(ClO2)泡腾片的主要成分。实验室以氯酸钠(NaClO3)为原料先制得ClO2,再制备NaClO2粗产品,其流程如图:
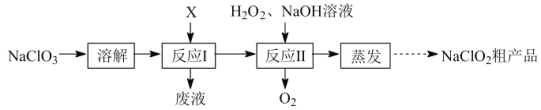
已知:①ClO2可被NaOH溶液吸收,反应为2ClO2+2NaOH=NaClO3+NaClO2+H2O。
②无水NaClO2性质稳定,有水存在时受热易分解。
(1)反应Ⅰ中若物质X为SO2,则该制备ClO2反应的离子方程式为___。
(2)实验在如图-1所示的装置中进行。
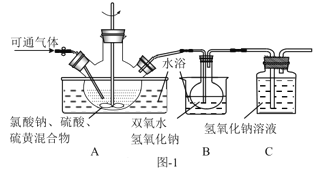
①若X为硫磺与浓硫酸,也可反应生成ClO2。该反应较剧烈。若该反应在装置A的三颈烧瓶中进行,则三种试剂(a.浓硫酸;b.硫黄;c.NaClO3溶液)添加入三颈烧瓶的顺序依次为___(填字母)。
②反应Ⅱ中双氧水的作用是___。保持反应时间、反应物和溶剂的用量不变,实验中提高ClO2吸收率的操作有:装置A中分批加入硫黄、___(写出一种即可)。
(3)将装置B中溶液蒸发可析出NaClO2,蒸发过程中宜控制的条件为___(填“减压”、“常压”或“加压”)。
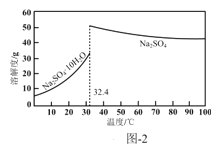
(4)反应Ⅰ所得废液中主要溶质为Na2SO4和NaHSO4,直接排放会污染环境且浪费资源。为从中获得芒硝(Na2SO4·10H2O)和石膏(水合硫酸钙),请补充完整实验方案:___,将滤液进一步处理后排放(实验中须使用的试剂和设备有:CaO固体、酚酞、冰水和冰水浴)。已知:CaSO4不溶于Na2SO4水溶液;Na2SO4的溶解度曲线如图2所示。
查看答案和解析>>
科目: 来源: 题型:
【题目】物质的量是高中化学中常用的物理量,请完成以下有关内容。
(1)咖啡含有咖啡因(化学式为C8H10N4O2),则咖啡因的摩尔质量为__________g/mol。
(2)0.2 g H2大约含有________个H原子。
(3)100 mL某Al2(SO4)3溶液中,c(Al3+)=2.0 mol/L,其中c(SO42-)= ________mol/L。
(4)8 克O2和O3的混合气体中氧原子的物质的量为 ________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】钛是一种性能非常优越的金属,21世纪将是钛的世纪。
(1)TiO2薄膜中掺杂铬能显著提高光催化活性。基态Cr原子的核外电子排布式为____。
(2)四乙醇钛能增加橡胶在金属表面的粘附性。其制备原理如下:TiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl
①Ti(OCH2CH3)4可溶于有机溶剂,常温下为淡黄色透明液体,其晶体类型为____
②N和O位于同一周期,O的第二电离能大于N的第二电离能的原因是_____;
③NH4Cl中存在的作用力有_____,NH4Cl熔沸点高于CH3CH2OH的原因是_____,Ti(OCH2CH3)4分子中C原子的杂化形式均为 ____。
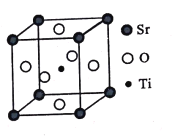
(3)钛酸锶(SrTiO3)可作电子陶瓷材料和人造宝石,其中一种晶胞结构如图所示。若Ti位于顶点位置,O位于____位置;已知晶胞参数为a nm,Ti位于O所形成的正八面体的体心,则该八面体的边长为_____ m(列出表达式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )
实验目的 | 实验操作 | |
A | 制备 | 将 |
B | 由 | 将 |
C | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
D | 配制 | 将氯化铁固体溶于盐酸中 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】CO和H2是工业上最常用的合成气,该合成气的制备方法很多,它们也能合成许多重要的有机物。回答下列问题:
(1)制备该合成气的一种方法是以CH4和H2O为原料,有关反应的能量变化如图所示。
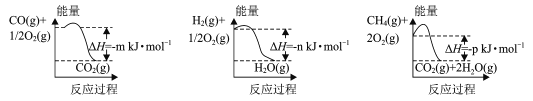
CH4 (g)与H2O(g)反应生成CO(g)和H2 (g)的热化学方程式为____。
(2)工业乙醇也可用CO和H2合成,常含一定量甲醇,各国严禁使用成本低廉的工业酒精勾兑食用酒,但一般定性的方法很难检测出食用酒中的甲醇。有人就用硫酸酸化的橙色K2Cr2O7溶液定量测定混合物中甲醇的含量,甲醇与酸性K2Cr2O7溶液反应生成CO2、Cr2(SO4)3等物质,写出其化学方程式 ___________。
(3)为了检验由CO和H2合成气合成的某有机物M的组成,进行了如下测定:将1.84gM在氧气中充分燃烧,将生成的气体混合物通过足量的碱石灰,碱石灰 增重4. 08 g,又知生成CO2和H2O的物质的量之比为3:4。则M中碳、氢、氧原子个数之比为____。
(4) CO2和H2合成甲醇涉及以下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) H=-49.58kJ/mol。在反应过程中可以在恒压的密闭容器中,充入一定量的CO2和H2,测得不同温度下,体系中CO2的平衡转化率与压强的关系曲线如图所示:
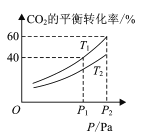
①反应过程中,表明反应达到平衡状态的标志是______;
A.生成3mol O-H键,同时断裂3mol H-H键 B.容器中气体的压强不再变化
C.容器中气体的平均摩尔质量不变 D.CH3OH的浓度不再改变
②比较T1与T2的大小关系:T1 ___T2 (填“<”、“=”或“>”)。
③在T1和P2的条件下,向密闭容器中充入1mol CO2和3mol H2,该反应在第5 min时达到平衡,此时容器的容积为2.4 L,则该反应在此温度下的平衡常数为____,保持T1和此时容器的容积不变,再充入1mol CO2和3mol H2,设达到平衡时CO2的总转化率为a,写出一个能够解出a的方程或式子 ___(不必化简,可以不带单位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 表示阿伏加德罗常数的值,下列说法中正确的是( )
表示阿伏加德罗常数的值,下列说法中正确的是( )
A. ![]() 与足量
与足量![]() 完全反应时转移电子数为
完全反应时转移电子数为![]()
B. ![]() 二氧化硅中含有
二氧化硅中含有![]() 键为
键为![]()
C. 56g铁与1mol氯气发生反应转移电子数为3NA
D. 含![]() 的浓盐酸与足量
的浓盐酸与足量![]() 在一定条件下反应生成
在一定条件下反应生成![]() ,转移电子数为
,转移电子数为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】取0.92 g由C、H、O三种元素组成的有机物A,在足量氧气中完全燃烧,若将燃烧产物通过碱石灰,碱石灰质量增加2.84 g;若将燃烧产物通过浓硫酸,浓硫酸质量增加1.08 g;已知:A的蒸气对氢气的相对密度为23。
(1)A的分子式是_____;
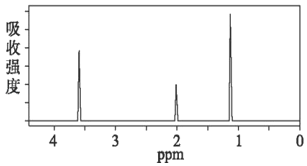
(2)A的1H核磁共振谱图如图所示,写出其结构简式:_____;它的一种同分异构体的结构简式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用 AgNO3 溶液分别滴定浓度均为 0.01 mol/L 的KCl、K2C2O4 溶液,所得的沉淀溶解平衡图像如图所示(不考虑 C2O42-的水解)。已知 Ksp(AgCl) 数量级为 10-10。下列叙述正确的是
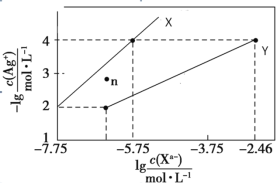
A.图中 Y 线代表的 AgCl
B.n 点表示 Ag2C2O4 的过饱和溶液
C.向 c(Cl-)=c(C2O42-)的混合液中滴入 AgNO3溶液时,先生成 AgCl 沉淀
D.Ag2C2O4+2Cl-=2AgCl+C2O42-的平衡常数为 10-0.71
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com