
科目: 来源: 题型:
【题目】已知:Ksp(CuS)=6.0×10-36,Ksp(ZnS)=3.0×10-25,Ksp(PbS)=9.0×10-29。在自然界中,闪锌矿(ZnS)和方铅矿(PbS)遇CuSO4溶液能转化成铜蓝(CuS)。下列有关说法不正确的是( )
A. ZnS转化成铜蓝的离子方程式为ZnS(s)+Cu2+(aq) ![]() Zn2+(aq)+CuS(s)
Zn2+(aq)+CuS(s)
B. 在水中的溶解度:S(ZnS)>S(PbS)>S(CuS)
C. 若溶液中c(Cu2+)=1×10-10 mol·L-1,则S2-已完全转化成CuS
D. 在白色ZnS浊液中滴加Pb(NO3)2溶液,不会生成黑色沉淀(PbS)
查看答案和解析>>
科目: 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。请回答下列问题:
(1)钴在元素周期表中的位置是___________,其基态原子的价电子排布图为___________。
(2)FeCO3是菱铁矿的主要成分,其中C原子的杂化方式为________;分子中的大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π![]() ),则CO32-中的大π键应表示为________。
),则CO32-中的大π键应表示为________。
(3)已知Fe2+半径为61pm,Co2+半径为65pm,在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3受热分解温度低于CoCO3,其原因可能是______。
(4)Co(NH3)5Cl3是钴的一种配合物,向含0.01mol该配合物的溶液中加入足量AgNO3溶液,生成白色沉淀2.87g。则该配合物的配位数为_____。
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构(如图所示),则该晶体中与铁原子距离最近的铁原子数目为___________;若该晶胞参数为a pm,则该晶体的密度为___________g·cm-3(阿伏加德罗常数的值用NA表示)。
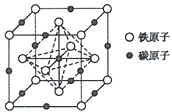
查看答案和解析>>
科目: 来源: 题型:
【题目】(15分)甲烷水蒸气催化重整(SMR)是传统制取富氢混合气的重要方法,具有工艺简单、成本低等优点。
回答下列问题:
(1)已知1000 K时,下列反应的平衡常数和反应热:
①CH4(g)![]() C(s)+2H2(g) K1=10.2 ΔH1
C(s)+2H2(g) K1=10.2 ΔH1
②2CO(g)![]() C(s)+CO2(g) K2=0.6 ΔH2
C(s)+CO2(g) K2=0.6 ΔH2
③CO(g)+H2O(g)![]() CO2(g)+H2(g) K3=1.4 ΔH3
CO2(g)+H2(g) K3=1.4 ΔH3
④CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) K4 ΔH4(SMR)
CO2(g)+4H2(g) K4 ΔH4(SMR)
则1000 K时,K4=____________;ΔH4=_________(用ΔH1、ΔH2、ΔH3来表示)。
(2)在进入催化重整装置前,先要对原料气进行脱硫操作,使其浓度为0.5 ppm以下。脱硫的目的为______________。
(3)下图为不同温度条件下电流强度对CH4转化率的影响。由图可知,电流对不同催化剂、不同温度条件下的甲烷水蒸气催化重整反应均有着促进作用,则可推知ΔH4____0(填“>”或“<”)。

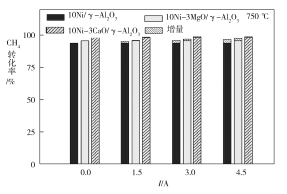
(4)下图为不同温度条件下6小时稳定测试电流强度对H2产率的影响。由图可知,随着温度的降低,电流对H2产率的影响作用逐渐____________(填“增加”“减小”或“不变”),600 ℃时,电流对三种催化剂中的____________(用图中的催化剂表示式回答)影响效果最为显著,当温度高于750 ℃时,无论电流强度大小,有无催化剂,H2产率趋于相同,其原因是______________。
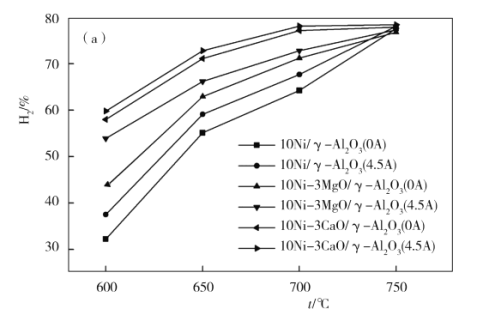
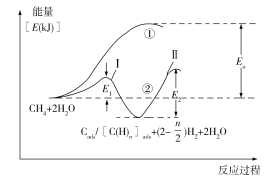
(5)我国科学家对甲烷和水蒸气催化重整反应机理也进行了广泛研究,通常认为该反应分两步进行。第一步:CH4催化裂解生成H2和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如CH4→Cads/[C(H)n]ads+(2–![]() )H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/[C(H)n]ads +2H2O→CO2 +(2+
)H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/[C(H)n]ads +2H2O→CO2 +(2+![]() )H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①_______②(填“>”“<”或“=”);控制整个过程②反应速率的是第_______步,其原因为____________________________。
)H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①_______②(填“>”“<”或“=”);控制整个过程②反应速率的是第_______步,其原因为____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。下列叙述一定正确的是
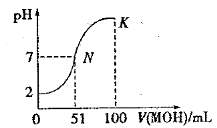
A.由图中信息可知HA为弱酸
B.在N点pH=7,酸碱恰好完全反应
C.常温时一定浓度的MA稀溶液显中性
D.K 点对应的溶液中,c(M+) + c(MOH)=2c (A-)
查看答案和解析>>
科目: 来源: 题型:
【题目】为除去粗盐中的CaCl2、MgCl2、硫酸钠以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:
![]()
(1)第⑤步中,操作B是___(填操作名称),第④步中,试剂Y是___。
(2)判断试剂X过量的方法是___。
(3)写出第②步中涉及反应的化学方程式___。
(4)第⑤步操作中得到的固体成分有:泥沙、CaCO3、Mg(OH)2、___(填化学式)。
(5)此实验方案尚需完善,具体步骤是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某三元羧酸 H3A 在表面活性剂、洗涤剂、润滑剂等方面具有重要的地位。常温时,向 10 mL 0.01 mol·L1 的 H3A 溶液中滴入 0.01 mol·L1 的 NaOH 溶液,H3A、H2A、HA2、A3的物质的量分数与溶液的 pH 的关系如 图所示。下列说法错误的是( )
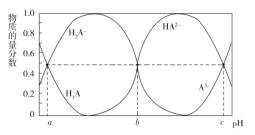
A.该温度下,H3A 的电离常数 Ka1=10a
B.若 b=7,加入 20 mL NaOH 溶液时,溶液的 pH<7
C.NaOH 溶液的体积为 30 mL 时,溶液中:c(OH)=3c(H3A)+2c(H2A)+c(HA2)+c(H+)
D.反应 2H2A![]() H3A+HA2在该温度下的平衡常数K=10a-b
H3A+HA2在该温度下的平衡常数K=10a-b
查看答案和解析>>
科目: 来源: 题型:
【题目】环保、安全的铝—空气电池的工作原理如下图所示,下列有关叙述错误的是
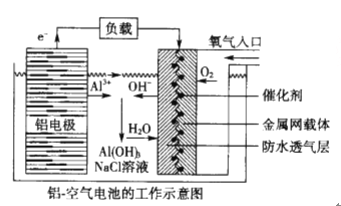
A. NaCl的作用是增强溶液的导电性
B. 正极的电极反应式为: O2+4e-+2H2O=4OH-
C. 电池工作过程中,电解质溶液的pH不断增大
D. 用该电池做电源电解KI溶液制取1molKIO3,消耗铝电极的质量为54g
查看答案和解析>>
科目: 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础。如图为实验室制取蒸馏水的实验装置。
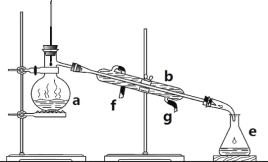
(1)写出下列仪器的名称:b.__;e___;
(2)若利用该装置分离四氯化碳和酒精的混合物,还缺少的仪器是___,将仪器补充完整后进行实验,温度计水银球的位置在___处。冷凝水由__(填f或g)口通入,另一口流出。仪器a___(填能或不能)直接加热。
(3)实验时a中除加入少量自来水外,还需加入少量__,其作用是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)

下列关于元素R的判断中一定正确的是( )
A. R的最高正价为+3价
B. R元素位于元素周期表中第ⅡA族
C. R元素的原子最外层共有4个电子
D. R元素基态原子的电子排布式为1s22s2
查看答案和解析>>
科目: 来源: 题型:
【题目】钾在氧气中燃烧时得到一种钾的氧化物晶体其结构如图所示,下列有关说法正确的是
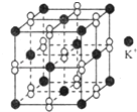
A.该氧化物属于离子晶体,其中只含离子键
B.1mol该晶体中含有的离子数目为3NA
C.晶体中与每个K+距离相等且最近的K+共有8个
D.晶体中每个K+同时吸引着6个阴离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com