
科目: 来源: 题型:
【题目】体积相同的盐酸和醋酸溶液,c(Cl-) = c(CH3COO-)= 0.01 mol/L,下列说法正确的是
A.pH:醋酸>盐酸
B.完全反应消耗NaOH的量:醋酸>盐酸
C.与相同的Na2CO3粉末反应的起始速率:醋酸<盐酸
D.分别用水稀释相同倍数后,所得溶液中:c (Cl-) = c (CH3COO-)
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列物质:①稀硫酸 ②小苏打 ③氨水 ④二氧化碳 ⑤FeCl3固体 ⑥稀NaOH溶液 ⑦硝酸亚铁溶液。
(1)上述物质中属于电解质的物质序号为______ 。
(2)有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是______。
(3)加入盐酸、NaOH溶液均能发生化学反应的物质序号为______。
(4)能导电的物质序号为_______________。
(5)④与⑥充分反应后,将溶液小火蒸干,得到固体混合物。固体组成成分可能是(用化学式表示)___________________________。
(6)实验室用⑤制备胶体的化学方程式为__________________________________。如果将1molFeCl3全部制成胶体,制得的胶体________(选填“带负电”“电中性”“带正电”),胶粒数目________NA(选填“大于”“等于”“小于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】茉莉醛具有浓郁的茉莉花香,结构简式如图所示。下列关于茉莉醛的叙述正确的是

A.茉莉醛与苯甲醛互为同系物
B.茉莉醛分子式为C14H20O
C.茉莉醛能使溴水褪色,并只发生加成反应
D.在一定条件下,lmol茉莉醛最多能与5 mol氢气加成
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ(1)标准状况下,1.7 g NH3与_______L H2S气体含有的氢原子数相同。
(2)2 mol的CO2与3 mol的SO3的原子数之比是__________。
(3)常温常压下22.4升CO2中分子个数___64克SO2的分子个数(填“>、<或=”)
(4)标准状况下,33.6L的NH3所含电子的物质的量约为______mol,将其溶解于水配成1L的溶液,则溶液的物质的量浓度为__________mol/L
(5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为________。
(6)某盐混合溶液中含有离子:Na+、Mg2+、Cl﹣、SO42﹣,测得Na+、Mg2+ 和Cl﹣的物质的量浓度依次为:0.2molL﹣1、0.25molL﹣1、0.4molL﹣1,则c(SO42﹣)=__________.
(7)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为_____________。
(8)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为_________________,NH3的体积分数为______________.
(9)VmLAl2(SO4)3溶液中含Al3+ ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中SO42-的物质的量浓度是_____________mol/L。
Ⅱ.请按照要求完成下列方程式。
(1)写出泡沫灭火器反应原理的离子方程式:_______________________________________。
(2)铁与水蒸气高温下反应的化学方程式:____________________________________________。
(3)NaCN属于剧毒物质,有一种处理方法其原理为CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色溶液,另一种与H+作用产生能使品红溶液褪色的刺激性气体,写出CN-与S2O32-反应的离子方程式:___________________________________。
(4)亚硝酸盐是毒性较强的物质,其具有较强的还原性,将亚硝酸钠溶液滴加到K2Cr2O7酸性溶液(橙色)中,溶液由橙色变为绿色(Cr3+),试写出反应的离子方程式:__________________________。
(5)将NaHSO4溶液滴入氢氧化钡溶液中至中性的离子反应方程式:_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温时,两个容积相同的烧瓶中分别盛有下面两种气体(同温同压),打开弹簧夹K,使两烧瓶内的气体充分混合后,容器内的压强最小的是
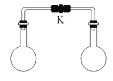
A.H2S和 SO2B.NH3和HCl
C.H2和Cl2D.NO和 O2
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA 为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,22.4L CCl4含有的分子数目为NA
B.7.8g Na2O2与水完全反应转移的电子数为0.1 NA
C.常温常压下,16 g O2和O3的混合气体中含氧原子2NA
D.常温常压下,1L0.l mol/LNaHSO4溶液中HSO4-数目为 0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】实验题
化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙,氢氧化铝组成;牙膏中其他成分遇到盐酸时无气体产生.
I.摩擦剂中氢氧化铝的定性检验:取适量牙膏样品,加水充足搅拌,过滤.
(1)往滤渣中加入过量NaOH溶液,过滤. 氢氧化铝与NaOH溶液反应的离子方程式是_______.
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸.这一过程发生反应的化学方程式依次为:__________________________________,__________________________________.
II.牙膏样品中碳酸钙的定量测定:利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.

依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气.其作用除了可搅拌B,C中的反应物外,还有:_________.
(4)C中反应生成BaCO3的离子方程式是___________________________________.
(5)下列各项措施中,不能提高测定准确度的是(______)(填标号).
A.在加入盐酸之前,应排净装置内的CO2气体
B.滴加盐酸不宜过快
C.在A~B之间增添盛有浓硫酸的洗气装置
D.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g.则样品中碳酸钙的质量分数为________.
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数.实验证明按此方法测定的结果明显偏高,原因是_________________.
(8)装置中U形管D中的碱石灰的作用是_____________________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】第三周期的三种元素甲、乙、丙,原子序数依次增大,且原子核外都有1个未成对电子,下列说法错误的是
A.金属性:甲>乙>丙B.三种元素的单质都能与水反应
C.离子半径:甲>乙>丙D.最高价氧化物对应水化物可两两相互反应
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O)的主要流程如下:
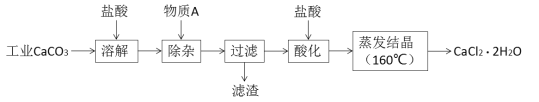
完成下列填空:
(1)除杂操作是加入物质A来调节溶液的pH,以除去溶液中的Al3+、Fe3+,根据下表所给信息,此时控制溶液的pH范围是_____________,加入的物质A是___________(写化学式)。
开始沉淀时的pH | 沉淀完全时的pH | 沉淀开始溶解时的pH | |
Al(OH)3 | 3.3 | 5.2 | 7.8 |
Fe(OH)3 | 1.5 | 4.1 | - |
(2)检验Fe3+是否沉淀完全的实验操作是____________________________________________。
(3)酸化操作是加入盐酸,调节溶液的pH,其目的是_________________________________。
(4)测定制得的样品的纯度,可采用如下方案:
a.称取0.750 g样品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用0.050 mol/L AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中,需要用到的玻璃仪器除了容量瓶、锥形瓶,还有__________________。
②计算上述样品中CaCl2·2H2O的质量分数为__________________(保留三位有效数字)。
③若配制和滴定操作均无误,但最终测定的样品中CaCl2·2H2O的质量分数偏高,写出可能导致该结果的一种情况___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物I是合成磷酸氨喹的中间体,一种合成路线如下:

回到下列问题:
(1)A中的官能团名称是______________。
(2)C的化学名称为____________。
(3)⑦的反应类型是_____________。
(4)已知③为取代反应,另一生成物为乙醇,E的结构简式为__________。
(5)写出G到H的反应方程式______________。
(6) H在一定条件下可以转化为(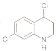 ),请写出任意一 种同时符合下列条件M的同分异构体_____________________。
),请写出任意一 种同时符合下列条件M的同分异构体_____________________。
①含苯环且苯环上有3个取代基
②含有NH2,能发生加聚反应
③核磁共振氢谱图为6组峰,峰面积比为1:1:1:2:2:2
(7)设计以对羟基苄氯(![]() )、CH3CH2OH为主要原料制备(
)、CH3CH2OH为主要原料制备(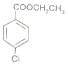 )的合成路线(无机试剂任选)。_________。
)的合成路线(无机试剂任选)。_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com