
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )。
A.1mol Na被完全氧化生成Na2O2,失去个NA电子
B.标准状况下,22.4L盐酸含有NA个HCl分子
C.标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5NA
D.50mL 12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定质量的镁和铝的混合物投入100ml盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.
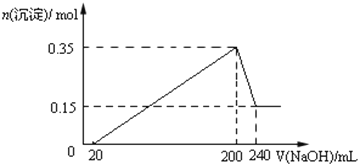
(1)原混合物中镁和铝的质量比为_______
(2)NaOH溶液的物质的量浓度为_______ molL﹣1
(3)生成的气体在标准状况下的体积为_______ L.
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
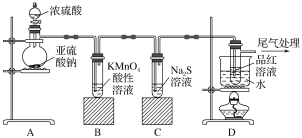
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是________,其中发生反应的化学方程式为_____。
(2)实验过程中,装置B、C中发生的现象分别是_____、 ____,这些现象分别说明SO2具有的性质是____和____。
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_________。
(4)尾气可采用________溶液吸收。(写化学式)
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是

A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

(1)写出下列仪器的名称:c.__________。
(2)仪器a~e中,使用前必须检查是否漏水的有___________。(填序号)
(3)若利用装置分离四氯化碳和酒精的混合物,温度计水银球的位置在_______处。冷凝水由____口流出(填f或g)。
(4)现需配制0.1mol/LNaOH溶液450mL,装置是某同学转移溶液的示意图。

①图中的错误是___________________。
②根据计算得知,所需NaOH的质量为_______。
(5)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。容量瓶用蒸馏洗涤后残留有少量的水_______;若定容时俯视刻度线______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl- 几种微粒,其中N2、ClO- 的物质的量随时间变化的曲线如图所示。下列说法正确的是

A.该反应中Cl- 为氧化产物
B.消耗1mol还原剂,转移3mol电子
C.反应后溶液的碱性增强
D.该反应氧化剂与还原剂物质的量之比为2:3
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.工业上利用电解饱和食盐水生产氯气(Cl2)、烧碱和氢气的化学方程式是:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑。
2NaOH+Cl2↑+H2↑。
(1)用双线桥表示出电子转移的方向和数目________,题干中反应改写成离子方程式是____。
(2)电解食盐水的过程中,被还原的元素是____________,氧化产物是______。
Ⅱ.四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-=Fe3O4↓+S4O62-+2H2O。请回答下列问题。
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是__________。
(2)反应的化学方程式中x=______。
(3)每生成1 mol Fe3O4,反应转移的电子为____mol,被Fe2+还原的O2的物质的量为_____mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是
A.氯气溶于水制备次氯酸:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:5 H2O2+2MnO4-+6H+ === 5O2↑+2Mn2++8H2O
C.向澄清石灰水中加入少量的NaHCO3溶液产生沉淀:Ca2++OH-+HCO3-=== CaCO3↓+H2O
D.用铜做电极电解NaCl溶液制备氯气:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
(1)浓盐酸在反应中显示出来的性质是__________(填编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)产生0.3mol Cl2,则转移的电子的物质的量为__________mol。
(3)氧化剂是__________,氧化产物是__________。
(4)![]() ,该反应的还原产物是__________;_________元素被氧化;若反应有
,该反应的还原产物是__________;_________元素被氧化;若反应有![]() 电子发生转移,则被还原的氧化剂是_________mol。
电子发生转移,则被还原的氧化剂是_________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是

A. 原混合物中n[Ba(OH)2]:n[NaOH] =1:2
B. 横坐标轴上p点的值为90
C. b点时溶质为NaHCO3
D. ab段发生反应的离子方程式依次为:CO2+2OH- = H2O+CO32-,CO2+H2O+ CO32-=2HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com