
科目: 来源: 题型:
【题目】顺铂是一种用于治疗癌症的药物,它的结构如下图所示。关于1 mol顺铂的下列说法中,正确的是( )
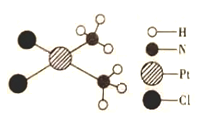
A.含氮元素的质量为14gB.含铂原子的数目约为6.02×1024
C.含氯元素的质量为35.5gD.含氢原子的物质的量6 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值。下列说法中正确的( )
A.11.7 g氯化钠晶体溶于水中Na+ 的数目为0.2 NA
B.19.6 g硫酸中含有的氧原子数为0.2 NA
C.标况下,1.12 L水中含有的原子数为0.15 NA
D.0.1mol·L-1的MgCl2溶液中,所含Cl- 的数目为0.2 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】在体积为VL的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)![]() 2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法不正确的是( )
2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法不正确的是( )
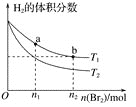
A.由图可知:T1>T2
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法
D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车等机动车尾气,含(CO、NO等)是城市空气的污染源。利用NSR技术可有效降低CO、NO的排放,回答有关问题:
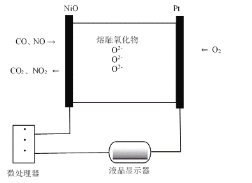
I.CO、NO的检测
(1)O2-的移动方向为__________。(填“向Pt电极”或“向NiO电极”)
(2)NiO电极上的电极反应为___________和__________。
II.NSR处理技术
NO的储存和还原在不同时段交替进行,实现两种有害气体,同时被处理,工作如图所示。
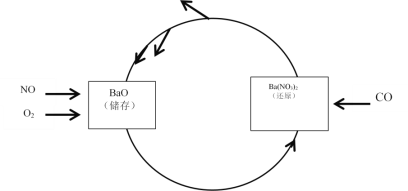
(3)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ/mol ①
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ/mol ②
则NSR技术工作原理的热化学方程式:2CO(g)+2NO(g)=N2(g)+2CO2(g)③的ΔH=________
(4)在一定温度下,向2L恒容密闭容器中充入等物质的量的NO和CO,发生反应,反应过程中c(NO)随时间的变化曲线如图所示。
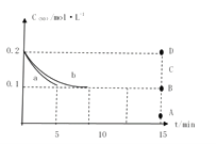
①图中曲线a或b中表示在该温度下使用NSR催化技术的是__________。
②曲线b中前10min内CO的平均反应速率v(CO)=_________;此温度下该反应的平衡常数K为_______。若平衡后,再向容器中充入CO和N2各0.8mol,则此时v(正)_____ v(逆)(填“>”、“<”或“=”)。
③若保持其他条件不变,15min时将容器的体积压缩至1L,20min时反应重新达到平衡,NO的物质的量浓度对应的点可能是____点。(填字母)
查看答案和解析>>
科目: 来源: 题型:
【题目】金属镁在点燃条件下与二氧化碳反应:2Mg+CO2![]() 2MgO+C。当0.4mol Mg与0.1mol CO2充分反应后,物质的种类及其数量正确的是( )
2MgO+C。当0.4mol Mg与0.1mol CO2充分反应后,物质的种类及其数量正确的是( )
A.0.2 mol MgO + 0.1 molC
B.0.4 mol MgO + 0.2 molC
C.0.3 mol Mg + 0.2 mol MgO +0.1mol C
D.0.2 mol Mg + 0.2 mol MgO+0.1 molC
查看答案和解析>>
科目: 来源: 题型:
【题目】AG表示溶液酸度:![]() 。常温下,用0.1mol/L的NaOH溶液滴定25 ml 0.1mol/L的CH3COOH滴定结果如图所示,下列分析正确的是()
。常温下,用0.1mol/L的NaOH溶液滴定25 ml 0.1mol/L的CH3COOH滴定结果如图所示,下列分析正确的是()
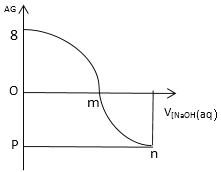
A.0.1mol/L的 CH3COOH溶液的pH=3
B.m点加入NaOH的体积为25mL
C.若pH=7,则溶液中水电离的c(OH-)=1.0×10-3.5 mol/L
D.随着NaOH溶液滴入,溶液中水的电离程度逐渐增大,m点最大
查看答案和解析>>
科目: 来源: 题型:
【题目】甲,乙两烧杯中各盛有500ml,相同浓度的盐酸和氢氧化钠溶液。向两个烧杯中分别加入18.0g的铝粉,反应结束后,测得生成的气体体积比为甲:乙=1:2,则下列说法正确的是
①甲烧杯中盐酸不足。
②乙烧杯中金属铝过量。
③甲烧杯中生成的气体体积为11.2L
④乙烧杯中的c(NaOH)=2mol/L
A.①③B.①④C.②③D.②④
查看答案和解析>>
科目: 来源: 题型:
【题目】饮用水中的NO3对人类健康会产生危害,为了降低饮用水中NO3的浓度,可以在碱性条件下用铝粉将NO3还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
(1)上述反应中,被氧化的元素_________,还原产物是________。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________。
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
(3)反应中每生成标况下22.4L N2,转移_______mol电子。
(4)请配平下列离子方程式。
____Fe2++____H+ +____NO3=____Fe3+ +____N2O↑+____H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-和NO3-的分离,实验过程如图所示:
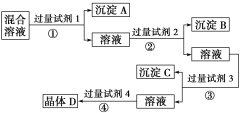
请回答下列问题:
(1)写出上述实验过程中所用试剂的名称:
试剂1__,试剂2__,试剂4___。
(2)加入过量试剂3的目的是___。
(3)在加入试剂4后,获得晶体D的实验操作④是___。
(4)写出过程②的离子方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,一定条件下发生反应并达到平衡:X(g)+Y(g) ![]() 2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
A. 升高温度,X的体积分数减小
B. 增大压强(缩小容器体积),Z的浓度不变
C. 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com