
科目: 来源: 题型:
【题目】W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是

A. 原子半径:Y>Z>W
B. 单质的还原性:X>Y
C. 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D. 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
查看答案和解析>>
科目: 来源: 题型:
【题目】用化学用语表示Na2CO3+2Cl2===2NaCl+Cl2O+CO2中的相关微粒,其中正确的是( )
A. Na+的结构示意图:![]()
B. Cl2O的结构式:Cl—O—Cl
C. 中子数比质子数多3的氯原子:3517Cl
D. CO2的电子式:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A.碳酸氢钠溶液与少量石灰水反应HCO3﹣+Ca2++OH﹣=CaCO3↓+H2O
B.氯化铵与氢氧化钠两种浓溶液混合加热OH﹣+NH4+![]() H2O+NH3↑
H2O+NH3↑
C.氢氧化铁与稀硫酸反应H++OH﹣=H2O
D.单质铜与稀硝酸反应Cu+2H++2NO3﹣=Cu2++2NO↑+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH=-99kJ·mol-1。请回答下列问题:
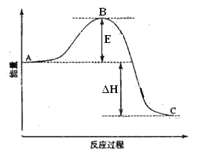
(1)图中A、C分别表示__________、______________,E的大小对该反应的反应热__________(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点______(填“升高”或“降低”),△H_____(填“变大”、“变小”或“不变”)理由是________________;
(2)图中△H =_______kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化为V2O5。写出该催化循环机理的化学方程式_______________________________。
(4)已知单质硫的燃烧热为296KJ·mol-1,计算由S(s)生成3molSO3(g)的△H(写出计算过程):________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
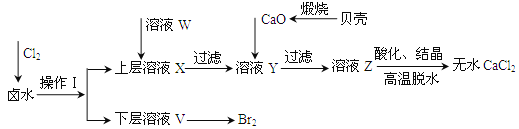
(1)操作Ⅰ使用的试剂是______,所用的主要仪器名称是_____。
(2)加入溶液W的目的是______,用CaO调节溶液Y的pH,可以除去Mg2+,由表中数据可知,理论上可选择的pH最大范围是______,酸化溶液Z时,使用的试剂为______。
开始沉淀时的pH | 沉淀完全时的pH | |
Mg2+ | 9.6 | 11.0 |
Ca2+ | 12.2 | c(OH-)=1.8molL-1 |
查看答案和解析>>
科目: 来源: 题型:
【题目】己知A是气态烃,完全燃烧时产生的CO2和,H2O的物质的量之比为1:1,A的相对分子量小于30。在如图所示的变化中,中间产物C跟葡萄糖一样也能银新制的Cu(OH)2发生反应产生砖红色沉淀,E有香味,F是高分子化合物(反应条件未写出)。
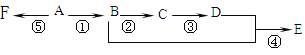
写出下列各步变化的化学方程式及反应类型。
反应①______;_______________
反应②______;________________
反应④______;___________________
反应⑤______;________________
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:CH4(g)+4NO3(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
若用标准状况下4.48 LCH4还原NO2至N2,整个过程中转移的电子总数________(阿伏伽德罗常数用NA表示),放出的热量为_________kJ。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
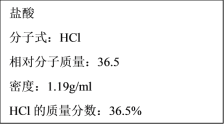
①该浓盐酸的物质的量浓度为___mol·L-1。
②某学生欲用上述浓盐酸和蒸馏水配制480ml物质的量浓度为0.4mol·L-1的稀盐酸,该学生需用量筒量取___mL上述浓盐酸进行配制,所需用的仪器除量筒、烧杯、胶头滴管和玻璃棒之外,还需要___。
(2)KClO3与浓盐酸在一定温度下反应会生成黄绿色的易爆物质二氧化氯,其变化可表述为:KClO3+HCl(浓)―KCl+ClO2↑+Cl2↑+
①请完成该化学方程式(将配平后的完整化学方程式写在答题卡上)___。
②浓盐酸在反应中显示出来的性质是__(填写编号)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
③若标况下产生了2.24LCl2,则生成ClO2的质量为__g。
④在KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,若标况下产生了6.72LCl2,则转移的电子数目为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2O2是重要的化工原料,具有多种用途。
(1)Na2O2具有氧化性,可以将SO2氧化为硫酸钠,写出该反应的化学方程式:___,该反应中,Na2O2的作用为___(填“还原剂”、“氧化剂”或“既是氧化剂又是还原剂”)。
(2)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选择适当的化学试剂和实验用品,用图中的实验装置进行实验,证明过氧化钠可作供氧剂。
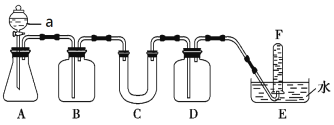
装置A是CO2气体的发生装置,请写出仪器a的名称___,B中盛饱和NaHCO3溶液,其作用是___。写出C中过氧化钠与二氧化碳反应的化学方程式___。D中盛放的试剂可以是____(填序号)。
①浓H2SO4 ②NaOH溶液 ③CaCl2溶液 ④Na2SO3溶液
(3)将一定量的Na2O2固体投入到含有下列离子的溶液中:NO3-、HCO3-、CO32-、Na+,反应完毕后,溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)___(填离子符号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】图中,A为一种中学化学中常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色实验均为黄色。

(1)写出下列物质的化学式:B___。
(2)以上6个反应中属于氧化还原反应的有___(填写编号)。
(3)写出A →C反应的离子方程式___。
(4)写出B→C反应的离子方程式:___;E→D的化学方程式:___。
(5)加热5.00gD和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31g,则原混合物中D的质量分数为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com