
科目: 来源: 题型:
【题目】反应 2KMnO4 + 16HCl =2KCl + 2MnCl2 + 5Cl2↑ + 8H2O 可用于实验室制取氯气,
(1)该反应中______是氧化剂,_____是氧化产物,_____元素被还原,
(2)浓盐酸在反应中显示出来的性质是________(填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)①用双线桥或单线桥标出下列反应的电子转移方向和数目2KMnO4 + 16HCl = 2KCl + 2MnCl2+ 5Cl2↑+ 8H2O_____________________
②在标准状况下,该反应产生2.24 L Cl2时,消耗氧化剂_____mol,被氧化的物质的质量为_____g。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.向FeBr2溶液中通入少量Cl2:2Br-+ Cl2 = Br2+ 2Cl-
B.向NH4Al(SO4)2溶液中加入过量KOH溶液:Al3+ + 4OH- = AlO2- + 2H2O
C.用氢氧化钠溶液吸收工业废气中的NO2:2NO2 + 2OH- = NO3- + NO2- + H2O
D.用惰性电极电解AlCl3溶液:2Cl- + 2H2O ![]() Cl2↑ + H2↑ + 2OH-
Cl2↑ + H2↑ + 2OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室从废定影液[含Ag(S2O3)23-和Br-等]中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取C12并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如下图所示:
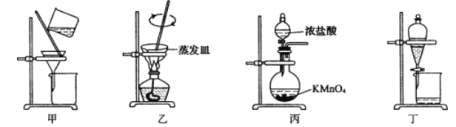
下列叙述正确的是
A. 用装置甲分离Ag2S时,用玻璃棒不断搅拌
B. 用装置乙在通风橱中高温灼烧Ag2S制取Ag
C. 用装置丙制备用于氧化过滤液中Br-的Cl2
D. 用装置丁分液时,先放出水层再换个烧杯继续放出有机层
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于化学与生产、生活的认识正确的是
A.禁止使用化学合成的化肥与农药,促进绿色食品和有机食品的生产
B.用Ba(OH)2处理含Cu2+的废水,可消除水中重金属离子的污染
C.煤经过气化和液化等物理变化可转化为清洁燃料
D.![]() 和CO2生成可降解聚合物
和CO2生成可降解聚合物 ![]() ,反应符合绿色化学的原则
,反应符合绿色化学的原则
查看答案和解析>>
科目: 来源: 题型:
【题目】铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。某厂为了变废为宝,将工业废水(含5.00×10-3 mol·L-1的Cr2O72-)处理得到磁性材料Cr0.5Fe1.5FeO4,设计了如下实验流程:
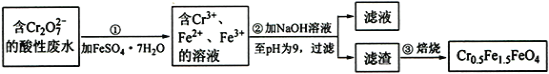
(1)第①步反应的离子方程式是_____。
(2)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有_____。
(3)为保证磁性材料的质量,应控制第①步反应后所得溶液中Fe3+与Fe2+的比例为___。在第②步过程中,须持续通入N2,原因是____________。
(4)将FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_____。
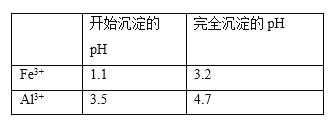
(5)以工业碳酸钙(含有少量A12O3、Fe3O4杂质)生产二水合氯化钙(CaC12·2H2O)的方法为:将工业碳酸钙溶于盐酸,________得到CaC12·2H2O。(在横线上补全实验步骤,实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计)。有关离子开始沉淀及沉淀完全时的pH见下表
查看答案和解析>>
科目: 来源: 题型:
【题目】一种从电镍含钴废渣(主要成分有Co(OH)3、Ni(OH)3、Fe(OH)3及少量Ca(OH)2、Mg(OH)2等杂质)中提取氧化钴(Co2O3)的工艺流程如下:
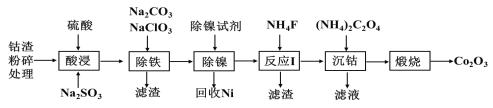
已知:Ksp(CaF2)=3.45×10-11,Ksp(MgF2)=7.42×10-11,Ksp[Co(OH)3]=2×10-44。
(1)在还原剂Na2SO3存在的条件下,钴渣易溶于酸中,请写出酸浸时Co(OH)3与Na2SO3反应的离子方程式______,该步操作中硫酸不宜过量太多的主要原因是 ____。
(2)除铁操作中Fe3+以黄钠铁矾Na2Fe6(SO4)4(OH)12形式从溶液中沉淀析出。中学检验Fe3+的溶液中混有Fe2+的常用试剂是________。
(3)反应Ⅰ中加入NH4F的目的______。
(4)沉钴操作发生的反应为(NH4)2C2O4+CoCl2![]() CoC2O4↓+2NH4Cl,也可用Na2C2O4代替(NH4)2C2O4,若要得到较为纯净的CoC2O4,则合理的加料方式是______(填字母)。
CoC2O4↓+2NH4Cl,也可用Na2C2O4代替(NH4)2C2O4,若要得到较为纯净的CoC2O4,则合理的加料方式是______(填字母)。
a.将Na2C2O4溶液与反应Ⅰ滤液同时加入到反应容器中
b.将Na2C2O4溶液缓慢加入到盛有反应Ⅰ滤液的反应容器中
c.将反应Ⅰ滤液缓慢加入到盛有Na2C2O4溶液的反应容器中
(5)450℃在空气中煅烧发生的化学反应方程式______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.(1)Fe2(SO4)3(写出电离方程式)_____
(2)铝和氢氧化钠溶液混合(写出反应的离子方程式)_____
(3)2H++CO32﹣═H2O+CO2↑(改写成化学方程式)________
(4)除去NaHCO3溶液中混有少量 Na2CO3溶液的离子反应方程式_____.
Ⅱ.有一瓶溶液只含Cl﹣、CO32﹣、SO42﹣、Na+、Mg2+、Cu2+六种离子中的某几种通过实验:
①原溶液![]() 白色沉淀;
白色沉淀;
②原溶液中加BaCl2溶液不产生沉淀;
③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解.
(1)试分析原溶液中一定含有的离子是_____,一定不含有的离子是_____,
(2)有的同学认为实验③可以省略,你认为是否正确_____(填是或否),理由是_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,另含少量杂质FeCO3和SiO2等)为原料制备高纯氧化镁的实验流程如下:
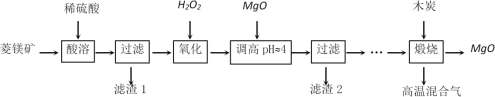
(1)酸溶时,MgCO3与稀硫酸反应的离子方程式为_____________________________。
(2)滤渣1的化学式为__________________。
(3)写出流程中“氧化”的离子方程式为______________________________________。
(4)调节pH时,使用pH试纸的具体操作是取一小块pH试纸放在洁净的玻璃片上,_______________________________________________________;滤渣2中除了过量的MgO外,还含有的物质是____________。
(5)高温煅烧过程中,同时存在以下反应:2MgSO4+C![]() 2MgO+2SO2↑+CO2↑;MgSO4+C
2MgO+2SO2↑+CO2↑;MgSO4+C![]() MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
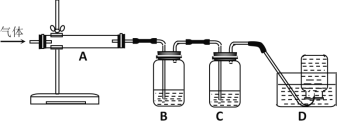
①D中收集的气体是_________________(填化学式)。
②B中盛放的溶液是__________________(填下列选项的字母编号)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.酸性KMnO4溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求完成下列各题:
(1)KOH的电子式:____________, CH(CH3)3的名称为:______________。
(2)有五种物质 :①Cu、②H2CO3、③BaSO4、④盐酸、⑤SO2,其中弱电解质是______(填序号,下同) ,非电解质是________________。
(3)钠与水反应的化学方程式为:_____________________。
已知在过量的FeSO4溶液中滴入几滴NaClO溶液,并加入过量H2SO4,溶液立即变黄,试写出该反应的离子方程式:_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知汽车尾气无害化处理反应为2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。下列说法不正确的是
N2(g)+2CO2(g)。下列说法不正确的是
A. 汽车尾气中有毒的NO和CO气体经充分反应后,理论上可完全转化为N2和CO2
B. 使用高效催化剂可有效增大正反应速率
C. 反应达到平衡后,NO的反应速率保持恒定
D. 单位时间内CO和CO2减少的物质的量相等时,反应达到平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com