
科目: 来源: 题型:
【题目】Ⅰ.(1)以下是日常生活中常见的一些物质:①液氯、②酒精、③CO2、④熟石灰、⑤碳酸钠、⑥稀盐酸、⑦CaO、③Na2O2、⑨Cu,请你指出(填写序号):
属于碱性氧化物的是___;能导电的是___。
(2)胶体粒子直径在___nm之间
Ⅱ.化学计量在化学中占有重要地位。根据计算填空:
(1)实验室某浓盐酸的质量分数为36.5%,密度为1.20g·cm-3,此浓盐酸的物质的量浓度是___mol·L-1;
(2)6.8gH2O2与标准状况下___LCO2所含氧原子数相同;
Ⅲ.除去Mg粉中的Al粉,指明应加入的试剂,写出有关的离子反应方程式。
Mg粉(Al粉):试剂___,离子方程式____。
IV.配平如下方程式
___NaClO+___NH3·H2O=___N2H4+___NaCl+___H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸四氨合铜晶体{[Cu(NH3)4]SO4·H2O}为深蓝色晶体,溶于水,不溶于乙醇,主要用作印染剂、杀虫剂及制备某些含铜的化合物。某实验小组拟制备氨气,并通入到硫酸铜溶液中制备硫酸四氨合铜,装置如下:
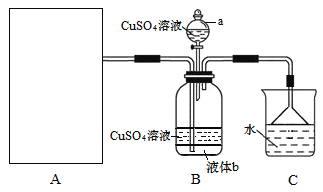
回答下列问题:
(1)装置A为制备氨气的实验装置,下列装置中可选用的有______(填标号)。
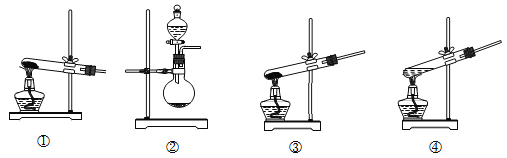
(2)装置a的名称为______;已知液体b与CuSO4溶液互不相溶,是常用的有机溶剂,则液体b的化学式为_____,作用是______。
(3)由于硫酸四氨合铜晶体能在热水中分解,实验时可向所得溶液中加入______来获得晶体。
(4)硫酸四氨合铜晶体中铜含量的测定可用碘量法。在微酸性溶液中(pH=3~4),Cu2+与过量I-作用,生成I2和CuI(不溶于水也不溶于非氧化性酸),生成的I2用Na2S2O3标准溶液滴定(已知滴定反应为:I2+2S2O32-=S4O62-+2I-)。
①滴定过程中使用的指示剂为______,滴定终点的现象为______。
②准确称取1.00g产品,配制成100mL溶液。取20mL该溶液,用0.050mol/LNa2S2O3标准溶液进行滴定,消耗标准溶液16.00mL,计算产品纯度为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求回答下列问题:
I.氯系消毒剂在生活中有广泛应用。
(1)NaClO2是饮用水的消毒剂,常用FeSO47H2O清除残留的亚氯酸钠。
①Fe2+的电子排布式为[Ar]________________________________。
②与SO42-互为等电子体的分子有____________________(写一种)。
③ClO2-中氯原子的孤电子对数为___________。
④常用K3[Fe(CN)6]检验水中的F2+。K3[Fe(CN)6]的配体是________________。
(2)ClO2是新一代饮用水消毒剂。沸点:ClO2________________(填“>”“<”或“=”)Cl2O,理由是________________________________________________。
Ⅱ.Fe、Cu为过渡金属元素,它们在工业生产中都有重要的应用。
(2)将乙醇蒸气通过赤热的氧化铜粉末,会发生反应:![]()
①有同学书写基态碳原子的核外电子排布图为![]() ,这样的书写不正确,违背了________。
,这样的书写不正确,违背了________。
②乙醛和乙醇的相对分子质量相差2,但是乙醇的沸点远高于乙醛,其主要原因是_______。
(2)Fe、Fe2+都能被硝酸氧化。HNO3中氮原子轨道的杂化类型为_______________________。
(3)NO能被FeSO4溶液吸收生成配合物![]() ,该配合物中心离子的配位数为__________________________。
,该配合物中心离子的配位数为__________________________。
(4)研究发现,阳离子的颜色与未成对电子数有关。例如,Cu2+、Fe2+、Fe3+等。Cu+呈无色,其原因是_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
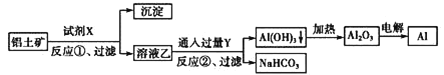
下列叙述不正确的是( )
A.试剂X可以是氢氧化钠溶液
B.反应①过滤后所得沉淀为氧化铁
C.图中所示转化反应都不是氧化还原反应
D.反应①的离子方程式为Al2O3+2OH-=2AlO2-+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】已知无色溶液X可能含有H+、Na+、NH4+、Mg2+、Al3+、CO32-、NO3-、SO42-中的几种离子,某化学兴趣小组通过如下实验确定了其成分(其中所加试剂均过量,气体体积已转化为标准状况):
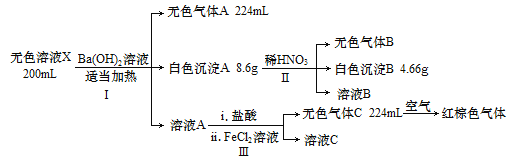
回答下列问题:
(1)实验Ⅱ可确定无色溶液X中一定不存在的离子有________。
(2)无色气体A的空间构型为_______;白色沉淀A的成分为_______(写化学式)。
(3)实验Ⅲ中的第ii步操作对应发生的反应的离子方程式为________。
(4)该无色溶液X中一定存在的阳离子及其物质的量浓度为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以甲醇为原料制取高纯H2是重要的研究方向。回答下列问题:
(1)甲醇水蒸气重整制氢主要发生以下两个反应。
主反应:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H=+49kJ·mol-1
CO2(g)+3H2(g) △H=+49kJ·mol-1
副反应:H2(g)+CO2(g) ![]() CO(g)+H2O(g) △H=+41kJ·mol-1
CO(g)+H2O(g) △H=+41kJ·mol-1
①甲醇在催化剂作用下裂解可得到H2和CO,反应的热化学方程式为__________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________________。
②适当增大水醇比[n(H2O):n(CH3OH)],有利于甲醇水蒸气重整制氢,理由是___________。
③某温度下,将n(H2O):n(CH3OH)=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为_________________(忽略副反应)。
(2)工业上常用CH4与水蒸气在一定条件下来制取H2,其反应原理为:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=+203kJ·mol-1,在容积为3L的密闭容器中通入物质的量均为3mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示。
CO(g)+3H2(g) △H=+203kJ·mol-1,在容积为3L的密闭容器中通入物质的量均为3mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示。
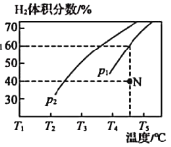
压强为p1时,在N点:v正_______v逆(填“大于”“小于”或“等于”),N点对应温度下该反应的平衡常数K=________mol2·L-2。
查看答案和解析>>
科目: 来源: 题型:
【题目】半导体工业会产生含氢氟酸的废水。回答下列问题:
(1)为了测定某含氢氟酸的废水中HF浓度,量取25.00mL废水,滴入2~3滴酚酞试液,用0.0100molL-1NaOH标准溶液滴定,用去27.00mL。滴定终点的判断方法是____________;废水中的c(HF)=__________________molL-1 (精确到0.0001)。
(2)用石灰乳处理含氢氟酸的废水时,会得到含氟底泥(主要含CaF2、CaCO3、CaSO4)。含氟底泥可用于制取氟化钙,其生产流程如下:
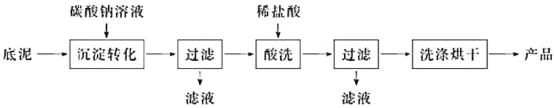
已知:氟化钙难溶于水,微溶于无机酸。
①“沉淀转化”的目的是将CaSO4转化为CaCO3。从平衡移动的角度分析,沉淀能够转化的原理是____________________________。
②最终得到的产品质量比底泥中CaF2的质量少,其原因是___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。实验室制备少量NaClO2的装置如图所示。装置I控制温度在35~55°C,通入SO2将NaClO3还原为ClO2(沸点:11°C)。

回答下列问题:
(1)装置Ⅰ中反应的离子方程式为__________________。
(2)装置Ⅱ中反应的化学方程式为_____________________。
(3)装置用中NaOH溶液的作用是_____________。
(4)用制得的NaClO4/H2O2酸性复合吸收剂同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)和溶液pH对脱硫、脱硝的影响如图所示:

①从图1和图2中可知脱硫、脱硝的最佳条件是n(H2O2)/n(NaClO2)=________________。pH在_________________之间。
②图2中SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小。NO去除率减小的可能原因是___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-![]() Cl2↑+Mn2++H2O
Cl2↑+Mn2++H2O
B.稀硫酸与NaOH溶液反应:2H++2OH-=2H2O
C.醋酸洗涤铜器表面的碱式碳酸铜:Cu2(OH) 2CO3+4H+=2Cu2++CO2↑+3H2O
D.向沸腾的蒸馏水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH) 3(胶体)+3H+
Fe(OH) 3(胶体)+3H+
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A是聚合反应生产胶黏剂基料的单体,亦可作为合成调香剂I、聚酯材料J的原料,相关合成路线如下:

已知:在质谱图中烃A的最大质荷比为118,其苯环上的一氯代物共三种,核磁共振氢谱显
示峰面积比为3:2:2:2:1。
根据以上信息回答下列问题:
(1)A的官能团名称为__________________,B→C的反应条件为_____________,E→F的反应类型为_____________。
(2)I的结构简式为____________________,若K分子中含有三个六元环状结构,则其分子式为________________。
(3)D与新制氢氧化铜悬浊液反应的离子方程式为_______________________________。
(4)H的同分异构体W能与浓溴水反应产生白色沉淀,1 mol W参与反应最多消耗3 mol Br2,请写出所有符合条件的W的结构简式___________________________________。
(5)J是一种高分子化合物,则由C生成J的化学方程式为
______________________________________________________________________。
(6)![]() 已知:
已知:![]() (R为烃基)
(R为烃基)
设计以苯和乙烯为起始原料制备H的合成路线(无机试剂任选)。
[合成路线示例:]![]()
_____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com