
科目: 来源: 题型:
【题目】将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H22.8L(标准状况),原混合物质量可能是( )
A. 2g B. 4g C. 10g D. 12g
查看答案和解析>>
科目: 来源: 题型:
【题目】TiO2在光照射下可使水分解H2和O2,该过程类似植物的光合作用。如图是光照射下TiO2分解水的装置示意图。下列叙述正确的是( )
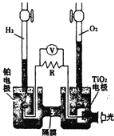
A.该装置可以将光能转化为电能,同时也能转化为化学能
B.铂电极上发生的反应为:H2-2e-=2H+
C.该装置工作时,电流由TiO2电极经R流向铂电极
D.该装置工作时,TiO2电极附近溶液的pH变大
查看答案和解析>>
科目: 来源: 题型:
【题目】用石墨做电极电解CuSO4溶液。通电一段时间后,欲使用电解液恢复到起始状态,应向溶液中加入适量的( )
A. CuSO4B. H2OC. CuOD. Cu(OH)2
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下,①5 g H2 ②11.2 L O2 ③2 mol H2O ④6.02×1023个 CO2分子。
(1)5gH2 的物质的量是_______,体积是_______;
(2)6.02×1023个CO2分子的物质的量是_____,质量是______;
(3)所含分子数最多的是______(请用序号回答,后同);
(4)所含原子数最多的是______;
(5)质量最大的是_______;
(6)体积最大的是_______;
(7) 体积最小的是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】烃A是一种植物生长的调节剂,A进行如图所示的转化可制得有果香味的液体E(C4H8O2)。请回答下列问题:
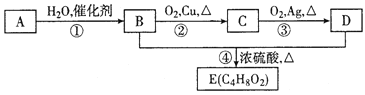
(1)A的电子式为___,D分子中所含官能团的名称为___。
(2)反应①的反应类型是____。
(3)A在一定条件下可以聚生成一种常见塑料,写出该塑料的结构简式___。
(4)请写出反应②的化学方程式__。
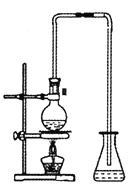
(5)实验室出反应④制备有机物E的装置如图,长导管的作用是导气和___,锥形瓶中盛放的液体是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】碘是人体中不可缺少的元素,为了预防碘缺乏,通常在精盐中添加一定的KIO3。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关资料,发现其检测原理是:KIO3 + 5KI + 3H2SO4 = 3I2 + 3K2SO4 + 3H2O
(1)用双线桥表示该反应中电子转移的方向和数目___________________________________,该反应中还原产物与氧化产物的质量之比是__________,0.2mol KIO3参加反应时,转移的电子为________mol。
(2)上面实验中用到一定物质的量浓度的稀硫酸,若配制1.0 mol/L的稀硫酸500mL,配制中需要用到的主要玻璃仪器有___________(填选项),需用18.0mol/L 浓硫酸_________mL。
a.100mL量筒 b.玻璃棒 c.100mL容量瓶 d.50mL量筒 e.胶头滴管
f.烧杯 g.500mL容量瓶
(3)下面操作造成所配稀硫酸溶液浓度偏高的有____________(填选项)。
a.溶解后溶液没有冷却到室温就转移;b.转移时没有洗涤烧杯、玻璃棒;c.转移过程中有少量液体流出;d.向容量瓶加水定容时眼睛俯视液面;e.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
(1)能说明该反应已达到平衡状态的标志是___(填字母序号)
a.反应速率4v正(NH3)=5v逆(N2)
b.单位时间里每生成5mol N2,同时生成4mol NH3
c.容器内压强不再随时间而发生变化
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
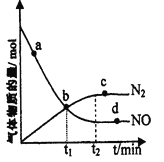
(2)某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中v(正)与v(逆)相等的点为____(选填字母)。
(3)一定条件下,在2L密闭容器内,反应2NO2![]() N2O4,n(NO2)随时间变化如表:
N2O4,n(NO2)随时间变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
用NO2表示0~2s内该反应的平均反应速率____。在第5s时,NO2的转化率为____。根据表中可以看出,随着反应进行,反应速率逐渐减小,其原因是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是半导体光电化学电池光解水制氢的反应原理示意图。在光照下,电子由价带跃迁到导带后,然后流向对电极。下列说法不正确的是

A. 对电极的电极反应式为:2H++2e-=H2↑
B. 半导体电极发生还原反应
C. 电解质溶液中阳离子向对电极移动
D. 整个过程中实现了太阳能→电能→化学能的转化
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
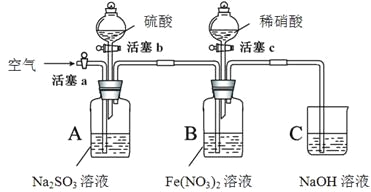
实验记录如下:
实验操作 | 实验现象 | |
I | 打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c | B中浅绿色溶液立即变为深棕色;一段时间后,溶液最终变为黄色。 |
II | 用注射器取出少量B装置中的溶液,加入KSCN溶液 | 溶液变为红色。 |
III | 打开活塞b,向A装置中加入足量硫酸,关闭活塞b | A中产生气体;B中有气泡,液面上有少量红棕色气体生成。 |
IV | 一段时间后,用注射器取出少量B装置中的溶液,…… | …… |
V | 打开活塞a,通入一段时间空气 | ———— |
请回答下列问题:
(1)保存Fe(NO3)2溶液时,常加入铁粉,目的是(用化学方程式表示)________。
(2)实验I中,发生反应的离子方程式是________。
(3)资料表明,Fe2+能与NO结合形成深棕色物质[Fe(NO)]2+: Fe2++ NO![]() [Fe(NO)]2+
[Fe(NO)]2+
用平衡移动原理解释实验I中溶液由深棕色变为黄色的原因是________________________。
(4)分析实验现象,同学们得出了结论。则:
① 实验IV的后续操作是________________,观察到的现象是________________。
② 由实验得出的结论是_______________________。
(5)实验反思
① 实验操作V的目的是_______________________________________。
② 实验操作III,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是________。
③ 有同学认为装置中的空气会干扰实验结论的得出,应在实验前通一段时间的氮气。你是否同意该看法,理由是________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com