
科目: 来源: 题型:
【题目】一学生设计入图所示装置进行NaHCO3的分解,并证实产物中有CO2产生。
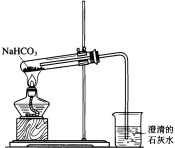
(1)试管中发生的化学反应方程式是____________________________。
(2)指出该学生设计的装置图的错误之处,并改正(文字说明即可)(至少2处)____________。
(3)烧杯中发生反应的离子方程式是_______________________________。
(4)如果将16.8gNaHCO3加热一段时间,然后将剩余固体溶于水,并加入足量的CaCl2溶液,最终得到白色沉淀5.0g,则NaHCO3分解百分率为______________,加CaCl2后反应的离子方程式为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】 下列说法正确的是( )
A.室温下,反应NH3(g)+HCl(g)=NH4Cl(s)能自发发生反应,则该反应的△H<0
B.甲醇燃料电池工作时,甲醇得到电子,发生还原反应
C.常温下,0.1molL﹣1CH3COOH溶液加水稀释后,溶液中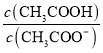 的值减小
的值减小
D.在Na2CO3溶液中加入少量Ca(OH)2固体,CO32﹣水解程度减小,溶液的pH减小
查看答案和解析>>
科目: 来源: 题型:
【题目】利用“化学计量在实验中的应用”的相关知识进行填空。
(1)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为______。
(2)在一定的温度和压强下,1体积 X2(g)跟3体积Y2(g)化合生成2体积化合物,则该化合物的化学式是________。
(3)将50 mL 0.1 mol·L![]() 的NaCl和100 mL 0.05 mol·L
的NaCl和100 mL 0.05 mol·L![]() CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl-)为________。
CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl-)为________。
(4)三种正盐的混合溶液中含有0.2 mol Na+、0.25 mol Mg2+、0.4 mol Cl-、SO42-,则n(SO42-)为_________。
(5)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为_____________。
(6)标准状况下,NH3与CH4组成的混合气体的密度为0.75g/L,该混合气体的平均摩尔质量为_____________,NH3的体积分数为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
84消毒液
(有效成分)NaClO
(规格)1000ml
(质量分数)37.25%
(密度)1.2g.cm-3
(1)该“84消毒液”的物质的量浓度约为________mol·L-1(保留2位有效数字)。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)_____mol·L-1(保留小数点后2位)。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制230 mL含NaClO质量分数为37.25%的消毒液。
①需要称量NaClO固体的质量为___________g
②其操作步骤可分解为以下几步:
A.将称量准确的NaClO固体,放入烧杯里,加适量蒸馏水使其溶解,并用玻璃棒搅拌
B.用约30mL蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都倒入容量瓶里
C.将NaClO溶液小心地用玻璃棒引流容量瓶里D.检查250mL容量瓶,是否漏水
E.将蒸馏水直接加入容量瓶,至液面接近刻度线
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切
完成上述步骤中的空白处_____________________;正确的操作顺序是(用字母填写):_______________;进行A步骤操作时,必须__________后,才能进行后面的操作。
(4)“84消毒液”与稀硫酸混合使用可增加消毒能力,某消毒小组人员用98%(密度为1.84g/ml)的浓硫酸配制100ml4.6mol/L的稀硫酸,用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为__________mol/L;
②需要量取浓硫酸的体积为__________ml。
(5)将所配制的稀H2SO4进行测定,发现实际浓度小于4.6 mol·L-1。请你分析下列哪些操作会引起所配浓度偏小_______(填字母)。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.洗涤量筒中的液体注入烧杯
F.烧杯未进行洗涤
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:

(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的电子式:____________________。
(2)A2B的化学式为_______________。反应②的必备条件是_______________。上图中可以循环使用的物质有_______________。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
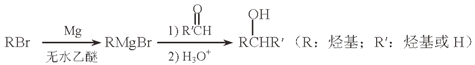
依据上述信息,写出制备![]() 所需醛的可能结构简式:_______________。
所需醛的可能结构简式:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.实验室用浓盐酸和MnO2混合加热制Cl2:MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B.将Cl2溶于水制备次氯酸:Cl2+H2O=2H++Cl﹣+ClO﹣
C.用过量的NaOH溶液吸收SO2:OH﹣+SO2=HSO3﹣
D.向AlCl3溶液中加入氨水:Al3++3OH﹣=Al(OH)3↓
查看答案和解析>>
科目: 来源: 题型:
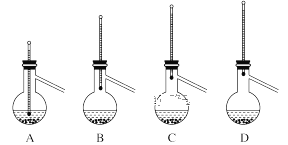
【题目】学习和研究化学,经常要进行实验,完成下列与实验相关的试题。
(1)实验室制备气体时,若实验装置出现下图所示情况时,不漏气的是__________ 。
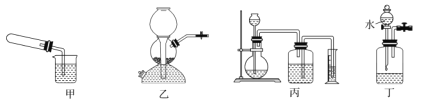
A.装置甲用手握试管一段时间,再松开手
B.装置乙放入CaCO3和稀盐酸,并关闭出气口活塞
C.装置丙烧瓶内放入金属Zn和稀硫酸
D.装置丁广口瓶中装有MnO2和H2O2,关闭出气口止水夹,打开分液漏斗活塞
(2)欲用萃取分液的方法在碘水中提取碘,一般可选用________为萃取剂,分液漏斗使用前须________并洗净备用。萃取时,先后加入待萃取液和萃取剂,经振摇并________后,将分液漏斗置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先_____________,然后打开活塞放出下层液体,上层液体从上口倒出。
(3)分液后蒸馏提纯时,需要用到的玻璃仪器除了酒精灯、蒸馏烧瓶、温度计、牛角管、锥形瓶外,还有___________;蒸馏烧瓶加热时需加垫石棉网,瓶中液体需加沸石,若已开始加热,发现忘记加沸石,应进行的操作是__________________;下列装置中温度计位置正确的是_____________,可能会导致收集到的产品中混有低沸点杂质的装置是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,此反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、Cr2(SO4)3、K2SO4、H2O七种物质。
(1)若将碳纳米颗粒分散到一定溶剂中,形成稳定的分散系,其所具有的性质是__________。
①丁达尔效应 ②加入饱和(NH4)2SO4溶液产生聚沉 ③可通过半透膜
(2)请用上述物质填空,并配平化学方程式:____C+____+____H2SO4→____K2SO4+________+____Cr2(SO4)3+____H2O。
(3)H2SO4在上述反应中表现出来的性质是________(填选项编号)。
A.氧化性 B.氧化性和酸性
C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上电解饱和食盐水制取氯气的化学方程式如下:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑.下列表示反应中相关微粒的化学用语正确的是( )
2NaOH+H2↑+Cl2↑.下列表示反应中相关微粒的化学用语正确的是( )
A.Na+的结构示意图: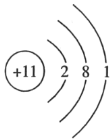
B.中子数为18的氯原子:![]() Cl
Cl
C.NaOH的电子式:![]()
D.Cl2的结构式:Cl=Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

(1)写出下列物质的官能团名称:B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com