
科目: 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:
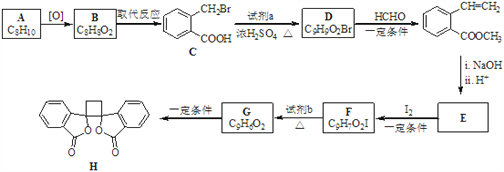
已知:i.RCH2Br ![]() R﹣HC═CH﹣R′
R﹣HC═CH﹣R′
ii.R﹣HC═CH﹣R′![]()
![]()
iii.R﹣HC═CH﹣R′![]()
(以上R、R'、R'代表氢、烷基或芳基等)
(1)A属于芳香烃,其名称是_______________________。
(2)D的结构简式是_______________________________。
(3)由F生成G的反应类型是________________________________________。
(4)由E与I2在一定条件下反应生成F的化学方程式是_____________________;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是_______________________________。
(5)下列说法正确的是___________(选填字母序号)。
A. G存在顺反异构体
B. 由G生成H的反应是加成反应
C. 1 mol G最多可以与1 mol H2发生加成反应
D. 1 mol F或1 mol H与足量NaOH溶液反应,均消耗2 molNaOH
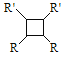
(6)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成 写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________________
写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学利用下图装置探究SO2的性质。

下列有关反应的方程式,不正确的是( )
A. ①中溶液显红色的原因: CO32-+ H2O![]() HCO3-+ OH-
HCO3-+ OH-
B. ①中溶液红色褪去的原因:2SO2 + CO32-+ H2O == CO2+ 2HSO3-
C. ②中溶液显黄绿色的原因:Cl2+ H2O == HCl + HClO
D. ②中溶液黄绿色褪去的原因:SO2+ Cl2 + 2H2O == H2SO4 + 2HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是![]()
![]()
A.摩尔是国际单位制中7个基本物理量之一
B.阿伏加德罗常数等于6.02×1023个12C中含有的碳原子数
C.物质的量是能把物质的质量和微观粒子数联系起来的一个物理量
D.若一分子NO、N2O的质量分别为ag、bg,则N原子的摩尔质量是(b-a)g/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度为1moI/L的是
A. 将6.2gNa2O溶解于水,并配成200mL溶液
B. 1L含1mol K+的K2SO4溶液
C. 将22.4LHC1溶于1L水
D. 将40.0 g NaOH溶于1L水
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇燃料电池能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注,其工作示意图如图,其总反应为:2CH3OH+3O2=2CO2+4H2O。下列说法不正确的是

A. 电极A是负极,发生氧化反应
B. 电池工作时,电解液中的H+通过质子交换膜向B电极迁移
C. 放电前后电解质溶液的pH不变
D. b物质在电极上发生的电极反应式为:O2+4e-+4H+=2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下。

请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。
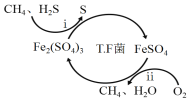
(1)过程i的离子反应方程式为_________________________________________。
(2)已知:
①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
pH | 0.7 | 1.1 | 1.5 | 1.9 | 2.3 | 2.7 |
Fe2+的氧化速率/g·L-1·h-1 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 |
在转化脱硫中,请在上表中选择最佳pH范围是_______<pH<_______,这样选择的原因是:_______________________________________________。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。
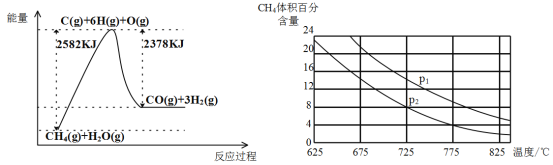
(3)①该过程的热化学方程式是__________________________________________。
②比较压强P1和p2的大小关系:P1 _________ P2(选填“>”“<”或“=”)。
③在一定温度和一定压强下的体积可变的密闭容器中充入1molCH4和1mol的水蒸气充分反应达平衡后,测得起始时混合气的密度是平衡时混合气密度的1.4倍,若此时容器的体积为2L,则该反应的平衡常数为______________(结果保留2位有效数字)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.H2提纯:将CO2和H2分离得到H2的过程如示意图
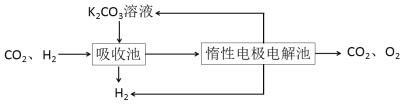
(4)吸收池中发生反应的离子方程式是____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温、容积为2L的密闭容器中通入1mol X和2mol Y,发生反应:X(s)+2Y(g) ![]() 3Z(g) ΔH=-a kJ/mol (a>0),5min末测得Z的物质的量为1.2mol。则下列说法正确的是
3Z(g) ΔH=-a kJ/mol (a>0),5min末测得Z的物质的量为1.2mol。则下列说法正确的是
A. 若反应体系中气体的压强保持不变,说明反应达到了平衡状态
B. 0~5min,X的平均反应速率为0.04mol ·L-1·min-1
C. 达到平衡时,反应放出的热量为a kJ
D. 达到平衡时,Y和Z的浓度之比一定为2∶3
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21。则下列说法不正确的是
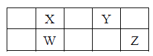
A. 原子半径大小:Y<XB. W的简单气态氢化物比X的稳定
C. Z的最高价氧化物对应的水化物是一种强酸D. W的氧化物可溶于烧碱溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
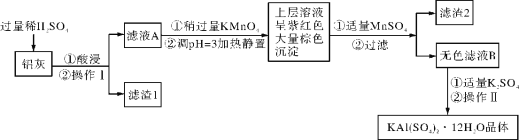
(1)明矾净水的原理是______________________________(用离子方程式表示)。
(2)检验滤液A中是否存在Fe2+的试剂是________________(只用一种试剂)。
(3)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_______________________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4- 转化为Mn2+):
________________________________________。
(4)已知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。
加入MnSO4发生反应的离子方程式为:________________________。滤渣2含有的物质是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的有( )
①分散质粒子直径介于![]() 之间的分散系称为胶体
之间的分散系称为胶体
②盐中不可能只含非金属元素
③只由一种分子组成的物质一定为纯净物,组成混合物的元素可能只一种
④与水反应生成酸的氧化物就是酸性氧化物
⑤化学变化不能实现一种原子变成另一种原子
⑥“水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化
A.2个B.3个C.4个D.5个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com