
科目: 来源: 题型:
【题目】氮、磷对水体的污染情况越来越受到人们的重视。回答下列问题:
(1)常温下,在pH约为9时,用澄清石灰水可将水体中的HPO42-化为Ca10(PO4)6(OH)2沉淀除去,该反应的离子方程式为_____________。
(2)除去地下水中的硝态氮通常用还原剂将其还原为N2。
①Prusse等提出的用Pd-Cu作催化剂,常温下,在pH为4.0~6.0时,可直接用H2将NO3-还原为N2,该反应的离子方程式为__________。研究发现用H2和CO2的混合气体代替H2,NO3-的去除效果比只用H2时更好,其原因是________。
②在pH约为5时,用纳米Fe粉可将NO3-还原为N2,Fe粉被氧化为Fe2+,该反应中氧化产物与还原产物的物质的量之比为_________。
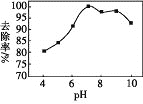
(3)实验测得相同条件下,用次氯酸钠脱除水体中的氨态氮的过程中(2NH3+3ClO-=N2+3H2O+3Cl-),pH与氨态氮的去除率关系如图所示,在pH大于9时,pH越大,去除率越小,其原因是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】自然界的氮循环如下图所示,下列说法不正确的是( )

A.①中N2与O2反应生成NO
B.②中合成氨属于人工固氮
C.③中氮元素只被氧化
D.氧元素参与了氮循环
查看答案和解析>>
科目: 来源: 题型:
【题目】铁元素是重要的金属元素,铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素具有氧化性也有还原性的物质是_________。
a.铁单质 b.氯化亚铁 c.铁红 d.Fe3O4
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO42-、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:____ Fe(OH)3+___ ClO-+_______=____FeO42-+____Cl-+______
(3)电子工业上用氯化铁腐蚀铜箔,制造印刷电路板,并从使用过的腐蚀废液(含有FeCl2、CuCl2、FeCl3)中回收铜,并获得氯化铁晶体,其工艺流程如下:回答下列问题:
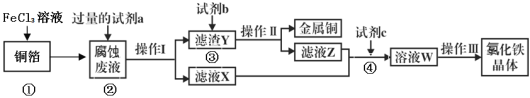
①反应①的化学方程式:_______________;
②从反应①和②可以判断出Fe2+、Cu2+、Fe3+的氧化性从强到弱顺序为:____________;
③操作I用到的玻璃仪器有烧杯、玻璃棒和___________;
④滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为:___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】据了解,铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈(形成了保护层)和有害锈(使器物损坏程度逐步加剧,并不断扩散),结构如图所示。

下列说法正确的是
A. Cu2(OH)3Cl属于有害锈
B. Cu2(OH)2CO3属于复盐
C. 青铜器表面刷一层食盐水可以做保护层
D. 用NaOH溶液法除锈可以保护青铜器的艺术价值,做到“修旧如旧”
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)请写出NaHCO3在水中的电离方程式:______________;NaOH溶液与NaHCO3溶液反应的离子方程式:________________。
(2)某无色透明溶液中可能大量存在NH4+、Na+、Ba2+、Fe3+、CO32-、SO42-、Cl-中的几种离子。从其中取两份各100mL溶液,进行如下实验:
①根据溶液颜色可以判断溶液中不存在的离子是_____________;
②取其中的一份溶液进行实验,加入过量氢氧化钠浓溶液并加热,共生成448mL气体(标准状况下),有关的离子方程式为______________;
③取另一份溶液加入过量Ba(NO3)2溶液,生成3.94g白色沉淀,过滤,向沉淀中再加入足量稀盐酸,沉淀全部溶解;根据以上实验结果确定:原溶液中肯定存在的离子有___________;请你设计实验方案证明该溶液中是否含有Cl-?_____________ 。
(3)某氮肥厂的氨氮废水中氮元素多以NH4+和NH3·H2O的形式存在。该厂的技术团队设计该废水处理方案流程如下:
![]()
①过程Ⅱ:在微生物的作用下实现NH4+→NO2-→NO3-转化,称为硝化过程。在碱性条件下,NH4+被氧气(O2)氧化成NO3-的总反应的离子方程式为________________。
②过程Ⅲ:在一定条件下向废水中加入甲醇(CH3OH),实现HNO3→NO2-→N2转化,称为反硝化过程。反硝化过程中甲醇(C元素为-2价)转化为CO2,若有6molHNO3完全转化成N2,消耗的甲醇的物质的量为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年6月1日,陨石坠落西双版纳,再次引发了人们对“天外来客”的关注,下图中(部分产物已略去),X、Y、Z为单质,其它为化合物;E为陨石的主要成分,也是石英砂的主要成分;A为黑色磁性氧化物,请回答下列问题:
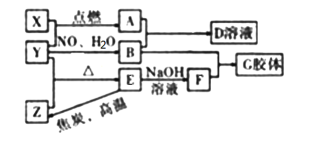
(1)关于E的说法正确的是___________________(填序号)
①E硬度大、熔点高、在自然界广泛存在
②E既能与NaOH溶液反应,又能与HF酸反应,其为两性物质
③可用盐酸除去E中混有少量X
④E是良好的半导体材料
(2)写出E与焦炭在高温下反应制取Z的化学方程式,并用单线桥分析标明电子转移数目______________
(3)写出E与NaOH溶液反应的离子方程式:_________________________________
(4)A与足量B的稀溶液反应生成D溶液,请用文字表述检验D中金属阳离子存在的一种实验方法_________
(5)F物质用氧化物的形式表示为:__________________。
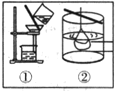
(6)已知在外加直流电作用下,G胶粒会向阳极区移动,这种现象叫做____________;净化G胶体可采用如图_____________(填序号)的方法,这种方法叫_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法正确的是(NA为阿伏加德罗常数的值)
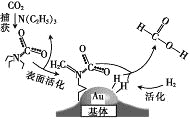
A. 标准状况下,22.4L CO2中所含的电子数目为16NA
B. 10.1g N(C2H5)3中所含的非极性共价键数目为0.3NA
C. 2mol Au与2mol H2中所含的分子数目均为2NA
D. 100g 46%的甲酸水溶液中所含的氧原子数目为5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是
A. Na![]() Na2O
Na2O![]() Na2CO3
Na2CO3
B. Al![]() Al2O3
Al2O3![]() Al(OH)3
Al(OH)3
C. Fe(OH)2![]() Fe(OH)3
Fe(OH)3![]() Fe2O3
Fe2O3
D. Na2CO3(aq)![]() NaHCO3
NaHCO3![]() CO2
CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,有强还原性。已知:①2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑,②H3PO2+NaOH(足量)=NaH2PO2+H2O。下列推断不正确的是
A. H3PO2的结构式为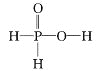
B. H3PO2具有强还原性,在空气中可能被氧化成磷酸
C. NaH2PO2是酸式盐
D. 每消耗1mol P4,反应①中转移6mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com