
科目: 来源: 题型:
【题目】Fe2O3和Cu2O都是红色粉末,常用作颜料.实验小组通过实验来探究某一红色粉末中Fe2O3和Cu2O的含量(不含其他物质)。
已知:Cu2O+H2SO4=Cu+Cu SO4+H2O
探究过程如下:
取少量该粉末放入 足量稀硫酸中,粉末完全溶解。
(1)①若滴加KSCN试剂后溶液不变为红色,则Fe2O3和Cu2O的物质的量之比为________。
②实验小组发现可通过对反应后溶液的称量来获得绿矾晶体(FeSO4·7H2O),设计了简单的流程来完成绿矾的制备:
混合液![]() 过滤
过滤![]() 一系列操作
一系列操作![]() 绿矾晶体(FeSO4·7H2O)
绿矾晶体(FeSO4·7H2O)
试剂a为_____________(填化学式),“一系列操作”为__________、__________、过滤、洗涤、干燥。
(2)测定Cu2O的质量分数:另取一种由Fe2O3和Cu2O组成的固体混合物9.28g,将其放在空气中充分加热(只发生Cu2O→CuO的反应),待质量不再变化时,测得质量为9.60g,则固体混合物中Cu2O的质量分数为_________________(保留三位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁煅烧反应为2FeSO4(s)![]() X(g)+Fe2O3(s)+SO3(g),有关说法正确的是
X(g)+Fe2O3(s)+SO3(g),有关说法正确的是
A. 该反应中X为还原产物
B. X能使溴水退色,说明X具有漂白性
C. 该反应中每生成1 mol Fe2O3转移电子数约为6.02×1023
D. 该反应生成的气体通入足量Ba(NO3)2溶液中,可得到两种沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】31.04gFe3O4、Fe2O3、FeO组成的固体混合物,用180 mL6.0 mol·L-1盐酸能恰好将之完全溶解。若将此固体混合物用CO完全还原,则生成的铁的物质的量为
A.0.2molB.0.3molC.0.4molD.0.5mol
查看答案和解析>>
科目: 来源: 题型:
【题目】”生活无处不化学”.下列关于生活中的问题解释不合理的是
A.食盐不慎洒落在 天然气的火焰上,观察到黄色火焰,其原因:2Na+O2![]() Na2O2
Na2O2
B.沾水的铁制品器皿高温灼烧会发黑,其可能原因:3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
C.Al(OH)3可用于中和过多的胃酸,其原因:Al(OH)3+3HCl=AlCl3+3H2O
D.明矾可以净水,是因为明矾[KAl(SO4)2·H2O]溶于水能生成Al(OH)3胶体
查看答案和解析>>
科目: 来源: 题型:
【题目】含有O22-的物质通常接有较强的氧化化性,一定条件下也可表现出还原性等,在现代工业及生活中有着重要的用途。
(1)过氧化钙可用作鱼苗长途运输中的供氧剂、消毒剂,写出过氧化钙的电子式:______,用化学方程式表示出它作供氧剂的原理:______。
(2)过氧化氢能氧化许多物质,也能被多种常见物质催化分解。
①向20mL0.05molL-1的H2O2溶液中缓慢通入标准状况下22.4mLSO2(忽略溶液体积的变化),充分反应后再加入几滴甲基橙试剂,溶液变红,则反应后溶液的pH为______。
②为证明MnO2能催化H2O2的分解,同学甲设计了如图所示的装置进行实验:
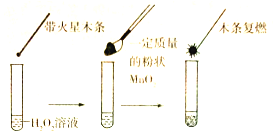
但乙同学认为,仅凭此实验不能确认MnO2是该反应的催化剂,他作出此判断的理由可能是______。
③FeCI3可催化H2O2的分解,其催化机理分为两个阶段,相应反应的化学方程式可表示为:
(i)2FeCl3+H2O2=2FeCl2+O2↑+2HCl。
(ii)______。
若在实验中加入几滴______,则能证明反应过程中确有Fe2+生成。
(3)过硫酸钠(Na2S2O8,有一个过氧根)其有强氧化性,Na2S2O8中硫元素的化合价为______,向Na2S2O8溶液中加入MnSO4后可得到紫色溶液,则此反应中氧化剂与氧化产物的物质的量之比为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】1,2 — 二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2—二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。

填写下列空白:
(1)写出本题中制备1,2—二溴乙烷的两个化学反应方程式:
___________________________________________________________
___________________________________________________________。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:_________________________________。
(3)容器c中NaOH溶液的作用是:__________________________________。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量比正常情况下超过许多,如果装置的气密性没有问题,试分析其可能的原因:_______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在工业上可用含SiO2、CeO2和Fe2O3的废料作原料来获得硫酸铁铵晶体(Fe2(SO4)3·2(NH4)2 SO4·3H2O),同时可回收CeO2,工艺流程设计如下
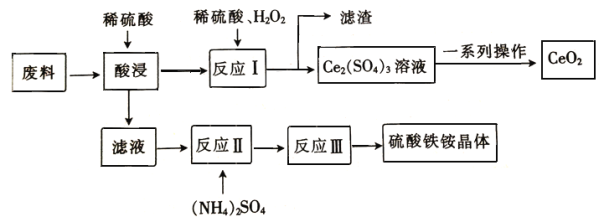
已知: ①SiO2、CeO2不溶于稀硫酸;②酸性条件下,CeO2可与H2O2反应;③“反应Ⅰ”所得溶液中含有Ce3+;④碱性条件下,NH4+与OH-结合生成NH3·H2O。
请回答下列问题
(1)“酸浸”时未发生的反应 物质是__________________(填化学式)。
(2)“滤液”中含有的阳离子有___________________(填离子符号)。
(3)写出“反应Ⅰ”的化学方程式:________________________________________。
(4)在酸性条件下,H2O2、CeO2两种物质中,氧化性较弱的是__________________(填化学式)。
(5)若往硫酸铁铵溶液中加入过量的NaOH,写出该反应的离子方程式:_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将物质X逐渐加入Y溶液中,生成沉淀的物质的量n2与所加X的物质的量n1的关系如图所示,符合如图所示的情况是
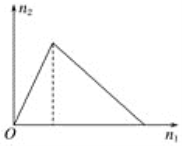
A. X为氢氧化钠,Y为氯化铝
B. X为氯化铝,Y为氢氧化钠
C. X为盐酸,Y为四羟基合铝酸钠
D. X为四羟基合铝酸钠,Y为盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl)是一种难溶于水的白色粉末,不溶于乙醇,可溶于浓盐酸和氨水,在潮湿空气中被氧化成绿色的碱式氯化铜[Cu2(OH)3Cl]。工业上常以海绵铜(主要成分是Cu,含有少量CuO)为原料生产CuCl,其工艺流程如下
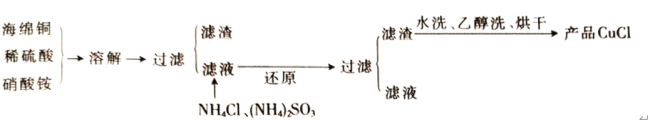
(1)配平“溶解”过程中发生的氧化还原反应的离子方程式:_________
Cu+ NO3-+ = Cu2++ NO↑+ H2O
(2)“还原”过程中,作还原剂的是__________(填化学式);写出“还原”过程中发生反应的离子方程式:__________________________________。
(3)写出CuCl在潮湿的空气中被氧化的化学方程式:__________________________。
(4)析出的CuCl晶体水洗后要立即用无水酒精洗涤,并在真空干燥机内于70℃下干燥2h,冷却密封包装。密封包装的原因是_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按如图路线合成:
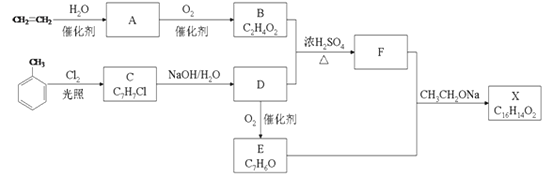
(1)写出由乙烯制取A的化学方程式:____。
(2)乙烯能使溴水和酸性KMnO4溶液褪色,二者褪色原理相同吗?_____。原因是______。
(3)以乙烯为原料,能否制得乙炔?_____。若能,请写出相关的化学方程式_______。
(4)请写出C的含有苯环的同分异构体的结构简式:______。
(5)写出甲苯与浓硝酸和浓硫酸的混合酸反应的化学方程式:_____。
(6)写出C→D的化学方程式:_______,
(7)C能发生消去反应吗?______。原因是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com