
科目: 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中某些反应的产物及条件没有全部标出)

根据以上信息填空:
(1)写出下列物质的化学式:A______ G__________ ;
(2)纯净的气体甲在气体乙中燃烧的现象:______________________________________;
(3)写出下列反应的离子方程式:反应①_________________________;反应④____________________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.制取乙酸乙酯时,饱和碳酸钠溶液作用:与乙酸反应生成乙酸钠溶解乙醇,降低乙酸乙酯的溶解度
B.淀粉、纤维素和油脂都属于天然高分子化合物
C.乙烷中含有杂质乙烯,可用催化加氢的方式除去
D.等质量的![]() 、
、![]() 、
、![]() 分别在氧气中完全燃烧,消耗氧气的量依次增多
分别在氧气中完全燃烧,消耗氧气的量依次增多
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是( )
A. 0.5 mol苯分子中含有C=C双键数为1.5 NA
B. 1 mol甲基(﹣CH3)所含的电子总数为10 NA
C. 标准状况下,1L甲醇完全燃烧后生成的CO2分子数目约为![]() NA
NA
D. 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某同学采用萃取—分液的方法从碘水中提取碘,主要操作步骤如下图:

①该同学所采用的萃取剂可能是______________(填序号)。
A 酒精 B 苯 C 四氯化碳 D 汽油
②甲、乙、丙3步实验操作中,不正确的是_______________(填“甲”、“乙”或“丙”)。
(2)实验室制取、净化并收集氯气涉及以下几个主要阶段:

现有以下2种试剂:A 饱和食盐水 B NaOH溶液
请在以上实际中选择填空(填“A”或“B”):
①X溶液应选用________________。
②尾气处理过程中,多余的氯气可用________________吸收。
查看答案和解析>>
科目: 来源: 题型:
【题目】食用二氧化硫漂白过的食品,对人体的肝、肾脏等有严重损害。某科研小组设计实验检验二氧化硫的漂白性。回答下列问题:
(一)二氧化硫的制备
实验室一般采用亚硫酸钠与硫酸(浓硫酸与水1:1混合)反应制取二氧化硫
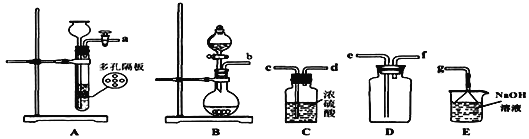
(1)写出实验室制SO2的化学方程式________________________________;
(2)欲收集一瓶干燥的二氧化硫,选择上图中的装置,其最佳连接顺序为:_______________________________________(按气流方向,用小写字母表示)。
(二)二氧化硫性质的检验
将上述收集到的SO2通入下列装置中,在一定温度下按图示装置进行实验。

(2)根据上述实验,回答下列问题:
序号 | 实验现象 | 解释原因 |
① | _________________________ | _________________________ |
② | 品红试液褪色 | SO2具有漂白性 |
③ | ________________________ | 反应的离子方程式____________________ |
④ | 溶液变浑浊,有黄色沉淀生成 | SO2+2H2S=3S↓+2H2O |
(3)用SO2漂白过的食品中一般残留有亚硫酸盐,科研小组设计了检验食品中是否含有亚硫酸盐的简单方法:将食品剪成碎末放入烧杯,加入适量的水,加热一会儿,冷却至室温,滴加盐酸和试剂A,观察液体的颜色变化既可。
①上述检验中试剂A是_____________。
②加热的作用是加快反应速率(或加快食品的溶解),加热时间不能太长的原因是_________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下 列叙述不正确的是( )

A. 若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛Na2SiO3,则C中溶液中变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 实验仪器D可以起到防止溶液倒吸的作用
查看答案和解析>>
科目: 来源: 题型:
【题目】从葡萄籽中提取的原花青素结构如右图所示,具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病。有关原花青素的下列说法不正确的是( )

A. 该物质既可看做醇类,也可看做酚类
B. 1 mol该物质可与4 mol Br2反应
C. 1 mol该物质可与7 mol NaOH反应
D. 1 mol该物质可与7 mol Na反应
查看答案和解析>>
科目: 来源: 题型:
【题目】氨能源的循环利用是目前研究的热点之一。
(1)一种可以快速启动的氨制氢工艺如图a所示:
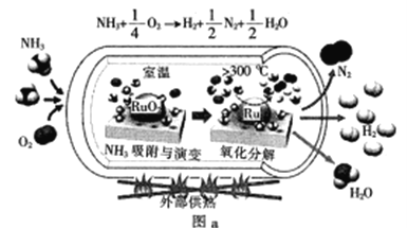
已知:![]()
![]()
快速制氢反应:![]() 的
的![]() =__
=__![]()
(2)1100℃时,在钨丝表面NH3分解的半衰期(浓度减小一半所需时间)如下表所示:
c(NH3)/mol/L | 4.56×10-3 | 2.28×10-3 | 1.14×10-3 | 5.70×10-4 | 2.85×10-4 |
时间/s | 0 | 440 | 660 | 770 | t5 |
表中的t5的值为_________:c(NH3)的值从4.56×10-3变化至2.28×10-3的过程中,平均反应速率试v(H2)=_____________ (保留三位有效数字)mol·L-1·S-1。
(3)在101kPa下,NH3分解的平衡转化率与温度的关系如图b所示:
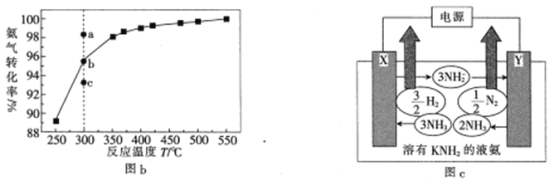
①温度为300℃,总压为101kPa时,图b中v(正)>v(逆)的点是_____(填“a”“b”或“c”)。
②为降低NH3分解的活化能可采取的措施有_____________________________
(4)已知液氮中存在下列平衡:2NH3(l)![]() NH4++NH2-。用溶有金属氨基化合物(如KNH2)的液氨作电解质电解制氢的工作原理如图c所示:
NH4++NH2-。用溶有金属氨基化合物(如KNH2)的液氨作电解质电解制氢的工作原理如图c所示:
①电极X的名称是__________________(填“阳极”或“阴极”)。
②图c中阳极的电极反应式为______________________________________________
③若图c中支持电解质改用NH4Cl,则阴极的电极反应式为__________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】一种利用失活的含镍催化剂(含NiB、MgO及SiO2等)为原料制备超细镍粉,其工艺流程如下:
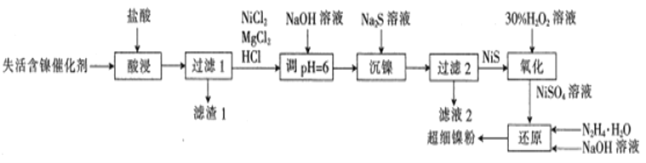
已知:pH=6时,Mg2+、Ni2+都不生成沉淀。
回答下列问题:
(1)非晶态NiB可由KBH4和Ni(NO3)2溶液反应制备。KBH4的电子式为_________
(2)“酸浸”时,为提高镍的浸取率可采取的措施是___________ (列举一点);滤值1中除了含有B单质外,还含有___________ (填化学式)。
(3)若流程中没有“NaOH溶液调pH=6”,则导致的后果是________
(4)“氧化”时发生反应的化学方程式为_______________;氧化时温度不宜超过50℃,其原因是_________________
(5)“还原”时产生无污染的气体,“还原”时发生反应的离子方程式为___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com