
科目: 来源: 题型:
【题目】用0.1mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述不正确的是( )
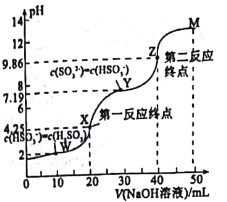
A.Ka2(H2SO3)的数量级为10-8
B.向X点加入少量澄清石灰水溶液,![]() 的值增大
的值增大
C.若将n(NaHSO3)与n(Na2SO3)=1:1混合,对应的点应在Y、Z之间
D.图中溶液中水的电离程度:W<X<Y<Z
查看答案和解析>>
科目: 来源: 题型:
【题目】铜是生产和生活中用量较多的金属。
(1)下列有关铜元素的说法中,不正确的是__________(填字母)
A.青铜、不锈钢、硬铝都是合金
B.铜表面易形成致密的氧化膜
C.铜与O2反应生成黑色的CuO
D.CuSO4·5H2O是一种混合物,加热后变为白色固体
(2)某化学小组为测定某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物![]() 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物![]() 测定剩余固体的质量
测定剩余固体的质量
①请写出方案Ⅰ中铜与稀硝酸反应的离子方程式:___________,该方案中稀硝酸表现出来的性质是___________(填字母)。
A.挥发性 B.酸性 C.氧化性 D.还原性
②方案Ⅱ比方案Ⅰ更易于实施,理由是________________。请写出方案Ⅱ中发生反应的化学方程式:____________,该反应产生气体在标准状况下的体积为________(铜铝混合物质量是m1g,反应后剩余固体的质量m2g,用含m1、m2的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)高铁酸钠(Na2FeO4)可作为高效、多功能水处理剂,其摩尔质量是__________。高铁酸钠可与水反应生成Fe(OH)3胶体、氢氧化钠和氧气,写出相应的离子方程式:_____________。
(2)戴维通过电解法首先制得了金属钠,随后几十年内,工业上采用铁粉和氢氧化钠高温熔融的方法制得钠蒸气,同时获得Fe3O4和氢气。写出该反应的化学方程式_____________,该反应中属于电解质但不属于氧化物的物质是________________(填化学式),若制得22.4L(折算为标准状况下)钠蒸气,转移电子的数目为________________。
(3)漂白粉常用于饮水、污水、排泄物及被污染的环境消毒,其主要成分是氯化钙和次氯酸钙[Ca(ClO)2],有效成分为次氯酸钙。为测得某漂白粉的有效成分含量,称取A g漂白粉样品溶解,往所得溶液中通入CO2至不再产生沉淀为止,反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,若反应生成次氯酸(HClO)的物质的量为Kmol,则该漂白粉中有效成分的质量分数为___________%(用含A、K的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年2月27日,科技日报报道中科院大连化学物理研究所创新性地提出锌碘单液流电池的概念,锌碘单液流电池中电解液的利用率达到近100%,进而大幅度提高了电池的能量密度,工作原理如图所示。下列说法不正确的是( )
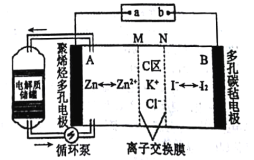
A.该电池放电时电路中电流方向为B→b→a→A
B.M为阴离子交换膜,N为阳离子交换膜
C.如果使用铅蓄电池进行充电,则a电极应连接铅蓄电池中的Pb电极
D.若充电时C区增加的离子数为2NA,则A极增重65g
查看答案和解析>>
科目: 来源: 题型:
【题目】已知a、b、c的分子式均为C9H10O2,结构简式如图所示。下列说法正确的是( )
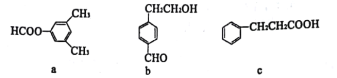
A.a、b、c都能与Na反应产生H2
B.a、b、c分子中所有碳原子可能共平面
C.b与c在浓硫酸加热条件下可以发生缩聚反应
D.c苯环上的一氯代物和二氯代物分别为3种和4种
查看答案和解析>>
科目: 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质,如图所示。
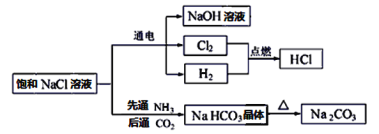
请回答下列问题:
(1)上述流程框图中属于电解质且存在熔融态导电的是________,属于非电解质的是_______。
(2)H2和Cl2的反应属于______________________(填字母。
A.化合反应 b.离子反应 c.氧化还原反应
(3)电解饱和NaCl溶液的化学方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。该反应中氧化产物是___________,每转移0.2mol电子,共产生标准状况下气体的总体积是_____L。
2NaOH+H2↑+Cl2↑。该反应中氧化产物是___________,每转移0.2mol电子,共产生标准状况下气体的总体积是_____L。
(4)Na2CO3溶液中通入少量HCl,发生反应的离子方程式为_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.等体积的CO2和CO,分子数目均为NA
B.常温下pH=12的NaOH溶液中,水电离出的氢离子数为10-12NA
C.标准状况下,22.4L的H2和22.4L的F2混合后,气体分子数为2NA
D.H2O(g)通过足量Na2O2(s)充分反应,固体增重bg时,反应中转移的电子数为bNA/2
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图所示装置进行实验,下列对实验现象的解释不合理的是

选项 | ①试剂 | ①中现象 | 解释 |
A | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
B | Na2SiO3溶液 | 产生胶状沉淀 | 酸性: H2SO3 >H2SiO3 |
C | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
D | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成 白色BaSO3沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中,满足图中所示物质转化关系且经过一步就能实现的是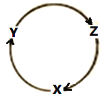
选项 | X | Y | Z |
A | Na | NaOH | Na2O2 |
B | Fe | FeCl2 | Fe(OH)3 |
C | NO | NO2 | HNO3 |
D | Al | Al2O3 | Al(OH)3 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】以某镍矿(主要成分为NiS、CuS、FeS、SiO2等)为原料制备一种多孔结构的细小镍晶粒,可用作有机物氢化反应的催化剂和储氢材料。工艺流程如图所示:[已知金属活动顺序为:Fe>Ni>(H)>Cu]
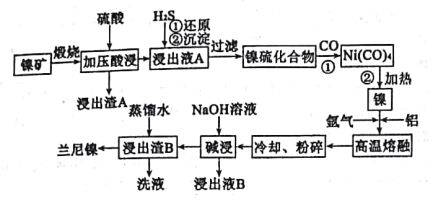
(1)已知该镍矿煅烧后生成Ni2O3,而加压酸浸液A中含有Ni2+,写出有关镍元素的加压酸浸的化学方程式___。
(2)已知Ni(CO)4的沸点是42.2℃,Ni(S)+4CO(g)![]() Ni(CO)4(g)的平衡常数与温度的关系如下:
Ni(CO)4(g)的平衡常数与温度的关系如下:

步骤①、步骤②的最佳温度分别是___、___(填选项代号)
A.25℃ B.30℃ C.50℃ D.80℃ E.230℃
(3)“高温熔融”时通入氩气的目的是___。
(4)“碱浸”是整个流程的核心步骤,该步骤的目的是___,发生反应的离子方程式为___。
(5)浸出液B可以回收,重新生成铝以便循环利用,请设计简单的回收流程:
(示例:![]() )浸出液B→___。
)浸出液B→___。
(6)镍硫化合物中会含有少量的CuS,也可以采用电解精炼的方法获得纯镍,流程为:
![]()
电解制粗镍时阳极发生的主要电极反应式为___;
精炼过程需控制pH2~5的原因___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com