
科目: 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温恒容的密闭体系中,可逆反应:A(s)+2B(g)![]() 2C(g) ΔH<0,不能作为该反应达到化学平衡的标志的是
2C(g) ΔH<0,不能作为该反应达到化学平衡的标志的是
①v正(B)=v逆(C) ②n(B)∶n(C)=1∶1 ③容器内压强不再改变
④容器内气体的密度不再改变 ⑤容器内混合气体的平均相对分子质量不再改变
A. ②③④⑤ B. ①③④ C. ②③ D. 全部
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)该反应的热化学方程式为_______________________________________。
(2)又知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大的优点是________________________。
Ⅱ.参考下列图表和有关要求回答问题。
(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________________________;
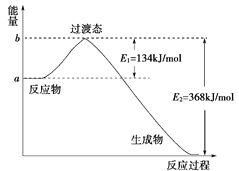
(2)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ/mol) | a | b | c | x |
已知白磷的燃烧热ΔH=-d kJ/mol,白磷及其完全燃烧的产物结构如图所示,则上表中x=______________________(用含有a、b、c、d的代数式表示)。
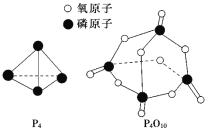
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
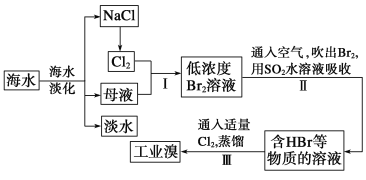
(1)请列举海水淡化的两种方法:__________________________、__________________________。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是__________________________。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的化学方程式为_________________, 由此反应可知,除环境保护外,在工业生产中应解决的主要问题是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)某种粒子有1个原子核,核中有17个质子,20个中子,核外有18个电子,该粒子的化学符号是______________。
(2)现有下列物质:①H2 ②Na2O2 ③NaOH ④H2O2 ⑤CaCl2 ⑥NH4NO3 ⑦H2S。只由离子键构成的物质是_________;只由极性共价键构成的物质是_____;由极性键和非极性键构成的物质是_______;由离子键和极性键构成的物质是_______。(填序号)。
(3)写出下列物质的电子式:CaF2:______________CO2:______________ NH4Cl:________________。
(4) 用电子式表示下列化合物的形成过程:H2S:__________________________________;MgCl2:_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是 ( )
A. 2H+(aq) +![]() (aq)+
(aq)+![]() (aq)+2
(aq)+2![]() (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H![]() O(1)
O(1) ![]() H=
H=![]() 114.6 kJ/mol
114.6 kJ/mol
B. 2KOH(aq)+ H![]() SO4(aq)= K
SO4(aq)= K![]() SO4(aq)+2H
SO4(aq)+2H![]() O(l)
O(l) ![]() H=
H=![]() 114.6kJ/mol
114.6kJ/mol
C. C8H18(l)+ ![]() O
O![]() (g)=8CO
(g)=8CO![]() (g)+ 9H
(g)+ 9H![]() O
O ![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
D. 2C8H18(g)+25O![]() (g)=16CO
(g)=16CO![]() (g)+18H
(g)+18H![]() O(1)
O(1) ![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积固定的密闭容器中存在如下反应:N2(g)+3H2![]() 2NH3(g) △H<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出如下关系图,分析正确的是
2NH3(g) △H<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出如下关系图,分析正确的是
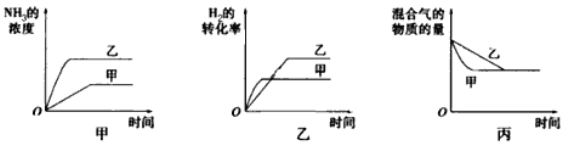
A. 图甲研究的是温度对反应的影响,且甲的温度比乙高
B. 图乙研究的是压强对反应的影响,且甲的压强比乙大
C. 图乙研究的是温度对反应的影响,且甲的温度比乙高
D. 图丙研究的是不同催化剂对反应的影响,且乙使用的催化剂效率比甲高
查看答案和解析>>
科目: 来源: 题型:
【题目】勒夏特列原理是自然界一条重要的基本原理,下列事实能用勒夏特列原理解释的是
A. NO2气体受压缩后,颜色先变深后变浅
B. 对2HI(g) ![]() H2(g)+I2(g)平衡体系加压,颜色迅速变深
H2(g)+I2(g)平衡体系加压,颜色迅速变深
C. 合成氨工业采用高温、高压工艺提高氨的产率
D. 配制硫酸亚铁溶液时,常加入少量铁屑以防止氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g)在温度为T1、T2(T2>T1)时,平衡体系中NO2的体积分数随压强变化如图所示。下列说法正确的是
2NO2(g)在温度为T1、T2(T2>T1)时,平衡体系中NO2的体积分数随压强变化如图所示。下列说法正确的是

A. 由图可知B点的平衡常数大于C点的平衡常数
B. A、C两点气体的颜色:A深,C浅
C. A、C两点气体的平均相对分子质量:A<C
D. 保持容器体积不变,再充入N2O2气体,平衡逆向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物X是一种黄酮类化合物的中间体,其结构简式如图所示。下列有关化合物X的说法正确的是( )
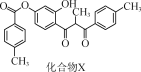
A.分子中所有碳原子共平面
B.分子中存在1个手性碳原子
C.化合物X不能使酸性KMnO4溶液褪色
D.1 mol化合物X最多可与12 mol H2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com