
科目: 来源: 题型:
【题目】向20mL某物质的量浓度的AlCl3溶液中逐滴滴加2mol/L NaOH溶液直至过量。经测定,加入的NaOH溶液的体积(mL)和所得沉淀的物质的量(mol)的关系如下图所示。则:
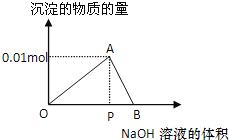
(1)写出代表各线段发生反应的离子方程式:OA段____________,AB段___________,图中线段OP∶PB=___________。
(2)计算原AlCl3溶液的物质的量浓度为_________。
(3)图中A对应的横坐标为______mL。
(4)当加入12mL NaOH溶液时,产生沉淀量为______mol。
(5)当加入的NaOH溶液过量时,使最初生成的沉淀部分溶解,要得到与(4)中相同的沉淀量,加入NaOH溶液的体积为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
![]()
资料:TiCl4及所含杂质氯化物的性质
化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
熔点/℃ | 69 | 25 | 193 | 304 | 714 |
在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 | |
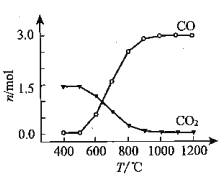
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:____________________。
② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。
③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
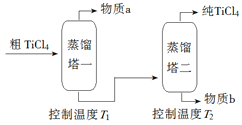
物质a是______________,T2应控制在_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素只有还原性的物质是_________。
A.Fe B.FeCl2 C.FeCl3 D.Fe2O3
(2)当人体缺铁时,往往要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:____________________________________________________________________。
②服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有________________(填化学性质)。
(3)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:
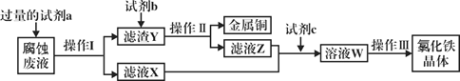
回答下列问题:
①试剂a是___________,操作I用到的玻璃仪器有烧杯、玻璃棒和___________。
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为___________。
③上述流程中操作III包括________________、________________、过滤、洗涤。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放。相关反应的热化学方程式如下:CaSO4 (s)+CO (g) ![]() CaO(s)+SO2 (g)+CO2 (g) △H1= +218.4kJ·mol-1(反应Ⅰ),CaSO4 (s) +4CO (g)
CaO(s)+SO2 (g)+CO2 (g) △H1= +218.4kJ·mol-1(反应Ⅰ),CaSO4 (s) +4CO (g) ![]() CaS(s) +4CO2(g)△H2=﹣175.6kJ·mol-1 (反应Ⅱ),结合反应Ⅰ、Ⅱ写出CaSO4 (s)与CaS (s) 反应的热化学反应方程式_______。
CaS(s) +4CO2(g)△H2=﹣175.6kJ·mol-1 (反应Ⅱ),结合反应Ⅰ、Ⅱ写出CaSO4 (s)与CaS (s) 反应的热化学反应方程式_______。
(2)NO2、SO2气体混合存在氧化物间的相互转化平衡:NO2(g)+SO2(g)![]() SO3(g)+NO(g),某活动小组对此反应进行研究实验
SO3(g)+NO(g),某活动小组对此反应进行研究实验
实验内容 | 实验现象 | 结论 | |
① | 将充有NO2、SO2气体的密闭烧瓶放入热水中 | 气体红棕色加深,一段时间后颜色不再变化 | △H___0 (填>、<或=) |
② | 在针筒中抽入5mL NO2和5mL SO2气体,封闭针筒前端,充分反应后,将活塞迅速推至5mL处 | 气体红棕色加深并保持不变 | 平衡____(填向左、向右或不)移动 |
③ | 在充有NO2、SO2混合气体的恒容容器中,达平衡后继续通入SO2气体 | _____ | 平衡向右移动,SO2的转化率____(填增大、减小或不变) |
(3)工业上用活性炭还原法处理NO,有关反应为:C(s) +2NO(g)![]() N2(g) +CO2(g)。为了提高NO的转化率,下列的措施可行的是___。
N2(g) +CO2(g)。为了提高NO的转化率,下列的措施可行的是___。
A.再加入一定量的碳 B.增大压强 C.用碱液吸收气体 D.使用催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】经检测某工厂的酸性废水中所含离子及其浓度如下表所示:
离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
(1)c(H+)=________mol/L。
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O).

① 工业废水中加入铁粉后,反应的离子方程式为:Fe+Cu2+ =Fe2++Cu、________________、_________________。
②试剂B是__________。
③ 操作③是_____________、_____________、过滤,最后用少量冷水洗涤晶体,在低温下干燥。
④通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是__________________。
⑤ 获得的FeSO4·7H2O需密闭保存,原因是___________________________。若将所得FeSO4·7H2O配成溶液,向溶液中滴加NaOH溶液的现象是_________________________________________________________________。
⑥上述1000 L废水经处理,可获得 FeSO4·7H2O的物质的量是_________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列能用勒夏特列原理解释的是( )
A.H2、I2、HI平衡混合气加压后颜色变深
B.工业上由氢气和氮气合成氨是在较高温度下进行的
C.Fe(SCN)3溶液中加入固体KSCN后颜色变深
D.SO2催化氧化成SO3的反应,往往需要使用催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)![]() nC(g),达到平衡后,测得A气体的浓度为0.5mol/L。保持温度不变,将容器的容积扩大一倍,再达平衡时,测得A气体的浓度为0.3mol/L,则下列叙述中正确的是
nC(g),达到平衡后,测得A气体的浓度为0.5mol/L。保持温度不变,将容器的容积扩大一倍,再达平衡时,测得A气体的浓度为0.3mol/L,则下列叙述中正确的是
A、x+y<n B、该化学平衡向右移动
C、B的转化率增大 D、C的体积分数减小
查看答案和解析>>
科目: 来源: 题型:
【题目】某含铜化合物的化学式为Cux(OH)y(CO3)z(Cu为+2价)。取该样品22.2 g,充分加热后,得到黑色固体氧化铜16.0 g,则该物质的化学式为
A.Cu2(OH)4CO3B.Cu3(OH)4CO3
C.Cu2(OH)2CO3D.Cu4(OH)2(CO3)3
查看答案和解析>>
科目: 来源: 题型:
【题目】锂海水电池的反应原理为:2Li+2H2O=2LiOH+H2↑,其示意图如图所示。有关该电池工作时说法错误的是

A.金属锂作正极
B.镍电极上发生还原反应
C.海水作为电解质溶液
D.可将化学能转化为电能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com