
科目: 来源: 题型:
【题目】教材插图具有简洁而又内涵丰富的特点。请回答以下问题 :
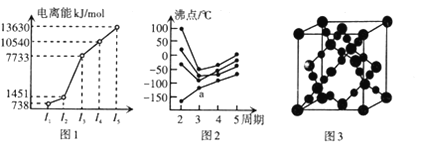
(1) 第三周期的某主族元素.其第一至第五电离能数据如图1所示.则该元素对应的原子有___________种不问运动状态的电子。
(2)如图2所示.每条折线表示周期表IVA–VIIA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是________。判断依据是__________。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该CO2晶体属于_____晶体。
(4) 第一电离能介于Al、P之间的第三周期元素有_____ 种。CaCl3中Ca原子的杂化力式为_______,写出一种与CaCl3且为电子体的离子的化学式_________ 。
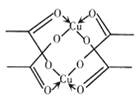
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性.而干冰、碘的晶体具有相似的结构特征 ,干冰晶体中一个分子周围有______个紧邻分子。醋酸铜晶体局部结构如右图,该晶体中含有的化学键是____________(填字母标号)。
a 极性键 b非极性键 c 配位键 d. 金属键
(6) Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图示中正确的是_____ (填字母标号)。
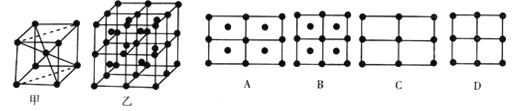
铁原子的配位数是__________,假设铁原于的半径是r cm.,该晶体的密度是ρg/cm3 则铁的相对原子质量为______________ (设阿伏加德罗常数的值为NA) 。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,用浓度为0.100 0 mol·L1的NaOH溶液滴定20.00 mL浓度均为0.100 0 mol·L1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是
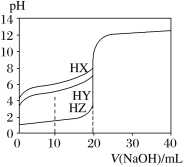
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线可得Ka(HX)的数量级是107
C.HX、HY与HZ溶液中均存在两种平衡
D.HY与HZ混合,达到平衡时c(H+)=![]() +c(Z)+c(OH)
+c(Z)+c(OH)
查看答案和解析>>
科目: 来源: 题型:
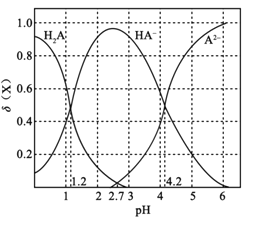
【题目】常温下,向0.1mol·L1二元弱酸H2A溶液中加入氢氧化钾固体改变溶液的pH,溶液中的H2A、HA、A2的物质的量分数![]() (X)随pH的变化如图所示[已知
(X)随pH的变化如图所示[已知![]() (X) =
(X) =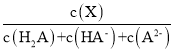 ]。下列叙述错误的是
]。下列叙述错误的是
A.pH=1.2时,c(K+)+c(H+)=c(H2A)+c(OH)
B.常温下,H2A的电离平衡常数Ka2=1042
C.pH=2.7时,c(HA)>c(H2A)=c(A2)
D.KHA溶液中离子浓度为c(K+)>c(HA)>c(OH)>c(H2A)>c(H+)>c(A2)
查看答案和解析>>
科目: 来源: 题型:
【题目】在冶金工业中,常以C作为还原剂,如温度高于980 K时,氧化产物以CO为主,低于980 K时以CO2为主。
(1)已知2CO(g)![]() CO2(g)+C(s),T=980 K时ΔH-TΔS=0。当体系温度低于980 K时,估计ΔH-TΔS________0(选填“大于”、“小于”或“等于”);当体系温度高于980 K时,该反应________自发进行(填“能”或“不能”)。
CO2(g)+C(s),T=980 K时ΔH-TΔS=0。当体系温度低于980 K时,估计ΔH-TΔS________0(选填“大于”、“小于”或“等于”);当体系温度高于980 K时,该反应________自发进行(填“能”或“不能”)。
(2)电子工业中清洗硅片上的SiO2(s)的反应为:
SiO2(s)+4HF(g)===SiF4(g)+2H2O(g)
ΔH(298.15 K)=-94.0 kJ·mol-1
ΔS(298.15 K)=-75.8 J·mol-1·K-1。
设ΔH和ΔS不随温度变化而变化,则此反应自发进行的温度是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳热还原法广泛用于合金及材料的制备。回答下列问题
(1) 一种制备氮氧化铝的反应原理为23Al2O3+ 15C+5N2=2Al23O27N5+15CO,产物Al23O27N5 中氮的化合价为_____,该反应中每生成 l mol Al23O27N5转移的电子数为_______________ 。
(2) 真空碳热冶铝法包含很多反应.其中的三个反应如下:
Al2O3 (s) +3C(s)=Al2OC(s) +2CO(g) △H1
2Al2OC(s)+3C(s)=Al4C3(s)+2CO(g) △H2
2Al2O3(s) +9C(s)= Al4C3(s)+6CO(g) △H3
①△H3=________ ( 用△H1、△H2表示).
②Al4C3可与足量盐酸反应制备简单的烃。该反应的化学方程式为____________。
(3)下列是碳热还原制锰合金的三个反应 ,CO与CO2平衡分压比的自然对数(![]() ) 与温度的关系如图所示(已知Kp 是用平衡分压代替浓度计算所得的平衡常数,分压=总压 × 气体的物质的量分数)。
) 与温度的关系如图所示(已知Kp 是用平衡分压代替浓度计算所得的平衡常数,分压=总压 × 气体的物质的量分数)。

I. Mn3C(s)+4CO2(g) 3MnO(s)+ 5CO(g) Kp(I)
II. Mn(s) +CO2(g) MnO(s) +CO(g) Kp (II)
III. Mn3C(s)+CO2(g) 3Mn(s) +2CO(g) Kp(III)
①△H>O的 反应是_________ (填“I ”“II” 或“III”)。
②1200K时在 一体积为 2L 的恒容密闭容器中有17.7gMn3C( s)和0.4molCO2 ,只发生反应I,5min后达到平衡,此时CO的浓度为0.125mol/L,则0~5 min内 v(CO2)=_______。
③在一体积可变的密闭容器中加入一定量的Mn(s )并充入一定量的CO2(g) .只发生反应
II,下列能说明反应II 达到平衡状态的是________ (填标号)。
A. 容器的体积不再改变
B.固体的质量不再改变
C.气体的总质量不再改变
④向恒容密闭容器中加入Mn3C并充入0.l molCO2, 若只发生反应III. 则在A点反应达到平衡时,容器的总压为akPa, CO2的转化率为______; A点对应温度下的Kp(III) =______。
查看答案和解析>>
科目: 来源: 题型:
【题目】将22.70 g小苏打和纯碱晶体(Na2CO3·10H2O)的混合物分成二等份,取其中一份溶于水,配成200 mL溶液,所得溶液中钠离子的物质的量浓度为0.50 mol·L-1;另一份加热至恒重,则固体质量减少( )
A.6.05 gB.5.35 gC.12.10 gD.16.40 g
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题:
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2,发生反应:2CO2(g)===2CO(g)+O2(g),该反应的ΔH________(填“>”“<”或“=”)0,ΔS________(填“>”“<”或“=”)0,在低温下,该反应________(填“能”或“不能”)自发进行。
(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式为2NO+2CO![]() 2CO2+N2。反应在常温下能够自发进行,则反应的ΔH________(填“>”“<”或“=”)0。
2CO2+N2。反应在常温下能够自发进行,则反应的ΔH________(填“>”“<”或“=”)0。
(3)已知在100 kPa、298 K时石灰石分解反应CaCO3(s)===CaO(s)+CO2(g)的ΔH>0,ΔS>0,则:
①该反应常温下________(填“能”或“不能”)自发进行。
②据本题反应数据分析,温度________(填“能”或“不能”)成为反应方向的决定因素。
(4)已知CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g),ΔH=+218 kJ·mol-1,该反应能够自发进行的反应条件是________。
CaO(s)+SO2(g)+CO2(g),ΔH=+218 kJ·mol-1,该反应能够自发进行的反应条件是________。
(5)某吸热反应能自发进行,则该反应的ΔS________(填“>”或“<”)0。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于反应自发性的说法正确的是
A. △H<0、△S>0的反应,有利于自发进行
B. 化合反应都是放热反应,分解反应都是吸热反应
C. 凡是放热反应都是自发的,吸热反应都是非自发的
D. 自发反应在任何条件下都能自动进行,现象明显
查看答案和解析>>
科目: 来源: 题型:
【题目】双极膜电渗析一步法盐制酸碱的技术进入到了工业化阶段,某科研小组研究采用 BMED膜堆(如图所示).模拟以精制浓海水为原料直接制备酸和碱。BMED膜堆包括阳离子交换膜、阴离子交换膜和双极膜( a . d)。已知:在直流电源的作用下.双极膜内中间界面层发生水的解离,生成 H+ 和 OH-。下列说法正确的是
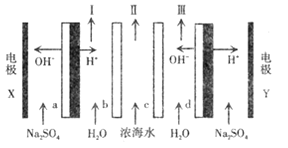
A.电极 Y连接电源的正极,发生还原反应
B.电解质溶液采用Na2SO4 溶液可避免有害气体的产生
C.I 口排出的是混合碱,II 口排出的是淡水
D.a左侧膜为阴离子交换膜 ,c 为阴离子交换膜
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.现有反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0。在850℃时,K=1。
CO2(g)+H2(g) △H<0。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K__________1(填“大于”“小于”或“等于”)。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向_____________(填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是_______________。
Ⅱ.在一固定容积的密闭容器中,保持一定温度,在一定条件下发生以下反应:2A(g)+B(g)![]() 3C(g),已知加入1 mol A和2 mol B且达到平衡后,生成了a mol C。
3C(g),已知加入1 mol A和2 mol B且达到平衡后,生成了a mol C。
(3)达到平衡时,C在反应混合气体中的体积分数是___(用含a的代数式表示)。
(4)在相同的实验条件下,若在同一容器中改为加入2 mol A和4 mol B,达到平衡后,C的物质的量为___mol(用含a的代数式表示)。此时C在反应混合气体中的体积分数与原平衡相比___(填“增大”“减小”或“不变”)。
(5)在相同实验条件下,若在同一容器中改为加入2 mol A和5 mol B,若要求平衡后C在反应混合气体中的体积分数仍与原平衡相同,则还应加入___mol C。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com