
科目: 来源: 题型:
【题目】工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:(已知Cd的金属活动性介于Zn和Fe之间)
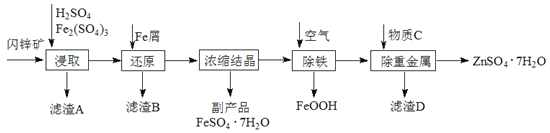
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为________。
(2)浸取过程中Fe2(SO4)3的作用是_______________,浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为____________________________________________。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为_______________________。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是____________________________________。
(4)置换法除重金属离子是Cd2+,所用物质C为_________。
(5)硫酸锌的溶解度与温度之间的关系如下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为__________、__________、过滤、干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】以硫酸渣(含Fe2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
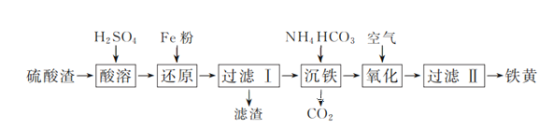
(1)“酸溶”中加快溶解的方法为____(写出一种)。
(2)“还原”过程中的离子方程式为_______。
(3)①“沉铁”过程中生成Fe(OH)2的化学方程式为_______。②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液中c(Ca2+)/c(Fe2+)=________。[已知Ksp(CaCO3)=2.8×10-9,Ksp(FeCO3)=2×10-11]
(4)“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,能缩短氧化时间,但缺点是_________。
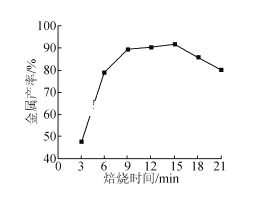
(5)焦炭还原硫酸渣炼铁能充分利用铁资源,在1225℃、n(C)/n(O)=1.2时,焙烧时间与金属产率的关系如图,时间超过15min金属产率下降的原因是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关叙述正确的是( )

A. 如上图所示是测定中和热的简易装置,大小两烧杯间填满碎泡沫塑料的作用是固定小烧杯
B. 若用50 mL 0.55 mol·L-1的氢氧化钠溶液,分别与50 mL 0.50 mol·L-1的盐酸和50 mL0.50 mol·L-1的硫酸充分反应,两反应测定的中和热不相等
C. 实验时需要记录初始温度T1和最高温度T2
D. 做一次实验根据公式即可得出中和反应的反应热
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G对白色念珠菌具有较强的抑制作用。G可经下图所示合成路线制备:

请回答下列问题:
(1)A→B的反应类型是__________。G中含氧官能团的名称为_________。E分子式为_________________。
(2)C与B互为同分异构体,能与小苏打反应放出CO2,与SOCl2发生取代反应生成D。C的结构简式为________。
(3)F中有无手性碳原子,如有则在下图中用*标出:________。
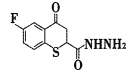
(4)写出同时满足下列条件的D的一种同分异构体的结构简式:________(不考虑立体异构)。
①含有—SH结构;②能在酸性条件下发生水解反应,两种水解产物均含有三种不同环境的H原子。其中一种水解产物既能遇FeCl3溶液显色,又能与Br2的CCl4溶液发生加成反应。
(5)写出以甲苯和乙醇为原料制备![]() 的合成路线流程图(其他试剂任选)。_____________________________。
的合成路线流程图(其他试剂任选)。_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。

(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目: 来源: 题型:
【题目】二茂铁是一种特殊的金属有机化合物,可用作燃料的节能消烟剂、抗爆剂等,熔点为173 ℃,在100 ℃时开始升华;沸点是249 ℃。实验室制备二茂铁的反应原理是:2KOH+FeCl2+2C5H6=Fe(C5H5)2+2KCl+2H2O,其装置如下图所示。

实验步骤为:
①在三颈烧瓶中加入25 g粉末状的KOH,并从仪器a中加入60 mL无水乙醚,充分搅拌,同时通氮气约10 min;
②再从仪器a滴入5.5 mL新蒸馏的环戊二烯(C5H6,密度为0.95 g·cm-3),搅拌;
③将6.5 g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25 mL装入仪器a中,慢慢滴入三颈烧瓶中,45 min滴完,继续搅拌45 min;
④再从仪器a加入25 mL无水乙醚搅拌;
⑤将三颈烧瓶中的液体转入仪器X中,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器a、X的名称分别是_____________。
(2)步骤①中通入氮气的原因是_____________(用化学方程式表示)。
(3)三颈烧瓶的适宜容积应为_________(选编号)。
①100 mL ②250 mL ③500 mL
(4)步骤⑤用盐酸洗涤的目的是_______________。
(5)步骤⑦是二茂铁粗产品的提纯,操作装置如图二所示,其操作名称为___________;该操作中棉花的作用是___________________。
(6)为了确认得到的是二茂铁,还需要进行的一项简单实验是__________。确定二茂铁的结构是下图b而不是c,其测定的谱图为_____________。
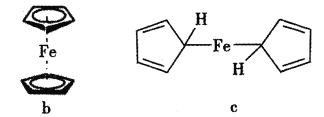
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在一定条件下2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ·mol-1。向一密闭容器中加入2molSO2和1molO2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2molSO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
2SO3(g) ΔH=-QkJ·mol-1。向一密闭容器中加入2molSO2和1molO2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2molSO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
A. Q>Q1>Q2B. Q2>Q>Q1C. Q1>Q>Q2D. Q>Q1=Q2
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可分为许多种,如燃烧热和中和热等。
(1)10g氢气燃烧生成气态水,放出1209kJ热量,若H2O(1)=H2O(g) △H=+44kJ/mol,写出表示氢气燃烧热的热化学方程式:______。
(2)利用50mL0.25molL-1硫酸、50mL 0.55molL-1NaOH溶液,在如图所示装置中测定中和热,回答下列问题:
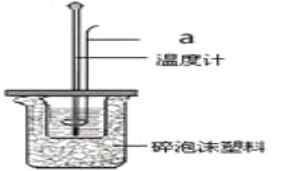
①仪器a的名称是_____。
②使用下列用品不是为了减小实验误差的是______。
A.两个量筒 B.仪器a C.泡沫塑料板 D.碎泡沫塑料
③向装有盐酸的小烧杯中倒入NaOH溶液的正确操作是____。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次性迅速倒入
④假设硫酸和氢氧化钠溶液的密度都是1gcm-3,又知中和反应后生成溶液的比热容c=4.18Jg-1℃-1,△t=3.4℃,该实验测得的中和热数值为____。(保留一位小数)
⑤下列操作不会使测量的中和热数值改变的是___。
A.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度
B.结合日常生活实际该实验在保温杯中进行
C.用 0.275molL-1Ba(OH)2溶液代替氢氧化钠溶液
D.把仪器a改为铜制品
E.用60mL 0.5molL-1盐酸与50mL 0.55molL-1 NaOH溶液反应
F.用0.5molL-1醋酸代替硫酸
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)根据如图所示情况,判断下列说法中正确的是____。
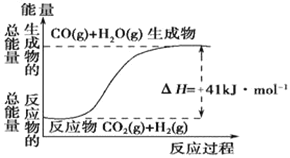
A.其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) △H=41kJmol﹣1
B.该反应为吸热反应
C.该反应为放热反应
D.若当H2O为液态时反应热为△H2,则△H2>△H
(2)25℃、101kPa下,已知1g氢气完全燃烧生成液态水时放出142.9kJ的热量,表示氢气燃烧热的热化学方程式是_____。
(3)已知反应:N2(g)+O2(g)=2NO(g) △H1
2H2(g)+O2(g)=2H2O(g) △H2
N2(g)+3H2(g)=2NH3(g) △H3
利用上述三个反应,计算4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H4 的反应焓变为:__(用含△H1、△H2、△H3的式子表示)。
(4)已知反应2HI(g)H2(g)+I2(g)的△H=+11kJmol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___kJ。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,从A处通入新制备的Cl2,关闭B阀时,C处的红色布条看不到明显现象;当打开B阀后,C处红色布条逐渐褪色。D瓶中装的是( )

①浓硫酸 ②NaOH溶液 ③H2O ④饱和NaCl溶液
A. ①③ B. ②④ C. ①② D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com