
科目: 来源: 题型:
【题目】塑料、橡胶等材料的交联剂E的合成路线如图所示:
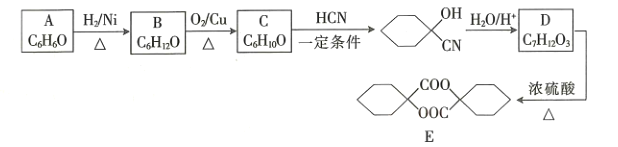
回答下列问题:
(1)B的名称为____________________。
(2)C生成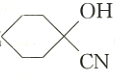 的反应类型是_________________,D中官能团的名称是________________。
的反应类型是_________________,D中官能团的名称是________________。
(3)D生成E的化学方程式为_____________________。
(4)E的同分异构体中符合下列条件的有______________种。(不考虑立体异构)
a.属于 的二取代物
的二取代物
b.取代基处于对位且完全相同
c.能够与![]() 溶液反应产生
溶液反应产生![]()
其中核磁共振氢谱有4组峰,峰面积之比为6:2:1:1的结构简式为_______________。
(5)参照题干中合成路线,设计以丙酮为主要原料制备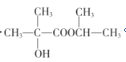 的合成路线______________(无机试剂任选)。
的合成路线______________(无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭烧瓶中,25 ℃时存在着平衡:2NO2(g)![]() N2O4(g)(正反应放热)。把烧瓶置于100 ℃的水中,则下列几项性质中不会改变的是
N2O4(g)(正反应放热)。把烧瓶置于100 ℃的水中,则下列几项性质中不会改变的是
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A. ①和③ B. ②和④ C. ④和⑤ D. ③和⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.0080mol/L。
(1)求该反应的平衡常数______。
(2)在上述温度下,该容器中若通入H2和I2蒸气各0.20mol,试求达到化学平衡状态时各物质的浓度______。
查看答案和解析>>
科目: 来源: 题型:
【题目】为从粗食盐水中除去Ca2+、Mg2+、SO42-等离子,以制得精盐水。某同学设计如下方案:
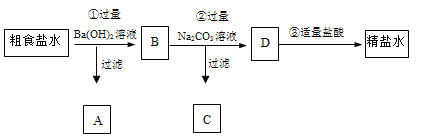
以下说法正确的是( )
A.A中主要有Mg(OH)2和BaSO4,也可能有一些Ca(OH)2
B.②中加入过量Na2CO3溶液的主要目的是为了除去Mg2+、Ca2+
C.D中有CO32-、Cl- 、Na+ 这3种离子
D.③中发生的反应只有2H++CO32-= H2O +CO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学反应中,不是氧化还原反应的是( )
A.3NO2 + H2O = 2HNO3 + NOB.2 H2+O2![]() 2H2O
2H2O
C.Cl2+H2O=HClO+HClD.CuCl2+Ba(OH)2=Cu(OH)2+BaCl2
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在标准状况下,由CO和CO2组成的混合气体8.96L,质量是16g。此混合物中CO和CO2的物质的量之比是_____________,CO的体积分数是_____________,该混合气体对于氢气的相对密度为________ 。
(2) 1.12g金属铁跟某稀盐酸恰好完全反应,得到100mL溶液,试计算:
①生成的气体在标准状况下的体积是_________________
②反应后所得溶液中溶质的物质的量浓度是______________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组向某2 L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)![]() D(g)+E(g) ΔH=Q kJ·mol-1。在T℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g) ΔH=Q kJ·mol-1。在T℃时,反应进行到不同时间测得各物质的物质的量如表:
时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T℃时,该反应的平衡常数K=________。
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是________(填字母编号)。
a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积 d.升高反应体系温度 e.同时加入0.2mol B、0.1mol D、0.1mol E
(3)写出下列电解质在水中的电离方程式:
CH3COOH:____________NaHSO4:______ NaHCO3:_________H2CO3:_________
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠(![]() )是一种解毒药,用于氰化物、砷、汞、铅、铋、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生
)是一种解毒药,用于氰化物、砷、汞、铅、铋、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生![]() 和
和![]() 。
。
实验Ⅰ.![]() 的制备。工业上可用反应:
的制备。工业上可用反应:![]() 制得,实验室模拟该工业过程的装置如图所示。
制得,实验室模拟该工业过程的装置如图所示。

(1)仪器a的名称是__________,仪器b的名称是_____________。b中利用质量分数为70%~80%的![]() 溶液与
溶液与![]() 固体反应制备
固体反应制备![]() 反应的化学方程式为_______________________。c中试剂为________。
反应的化学方程式为_______________________。c中试剂为________。
(2)实验中要控制![]() 的生成速率,可以采取的措施有_________________________(写出一条)。
的生成速率,可以采取的措施有_________________________(写出一条)。
(3)为了保证硫代硫酸钠的产量,实验中通入的![]() 不能过量,原因是_________________________。
不能过量,原因是_________________________。
实验Ⅱ.探究![]() 与金属阳离子的氧化还原反应。
与金属阳离子的氧化还原反应。
资料:![]() (紫黑色)
(紫黑色)
装置 | 试剂X | 实验现象 |
|
| 混合后溶液先变成紫黑色,30s后溶液几乎变为无色 |
(4)根据上述实验现象,初步判断最终![]() 被
被![]() 还原为
还原为![]() ,通过________________________(填操作、试剂和现象),进一步证实生成了
,通过________________________(填操作、试剂和现象),进一步证实生成了![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是______________(填序号)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)写出制备Fe(OH)3胶体的化学反应方程式:________________。
(3)如何用最简单的方法判断(1)中是否成功制备胶体?_________________________。
(4)取少量制得的胶体加入试管中,再加入少量(NH4)2SO4溶液,观察到的现象是__________,这种现象称为胶体的________________。
(5)Fe(OH)3胶体能稳定存在的主要原因是________(填序号)。
A. 胶粒直径小于1nm B. 胶粒带正电荷
C. 胶粒作布朗运动 D . 胶粒能透过滤纸
(6)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________(填序号)。
A.Fe(OH)3胶体粒子的直径在1~100nm之间 B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系 D.Fe(OH)3胶体的分散质粒子能透过滤纸
(7)向Fe(OH)3胶体中插入电极通电后,Fe(OH)3胶体粒子应该移向_______极,说明该胶体粒子带_____电;提纯Fe(OH)3胶体中混有的少量离子可以用的方法是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g)。
(1)在—定温度和压强下,CO(g)+2H2(g)![]() CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示)。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是________(填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度________(填“增大”、“不变”或“减小”)。
CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示)。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是________(填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度________(填“增大”、“不变”或“减小”)。
(2)判断该反应达到平衡状态的依据是________(填字母序号)。
a.混合气体的密度不变 b.混合气体的平均相对分子质量不变 c.2v逆(H2)=v正(CO) d.容器内CO、H2、CH3OH的浓度之比为1∶2∶1 e.CH3OH、CO、H2的浓度都不再发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com