
科目: 来源: 题型:
【题目】氧化还原反应原理在研究物质性质及物质转化方面具有重要的的价值。
(1)化合价是学习氧化还原反应的基础。在括号中写出以下几种物质中划线元素的化合价。
NaI(____) ClO3-(____) K2MnO4 (___) Br2(___)
(2)1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将其与浓盐酸混合加热,产生黄绿色气体,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。从反应物中任选一种物质,说明其发生氧化反应(或者还原反应)的理由_______。
MnCl2+Cl2↑+2H2O。从反应物中任选一种物质,说明其发生氧化反应(或者还原反应)的理由_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学探究Ba(OH)2和H2SO4反应的实质,利用下图装置进行实验。向20 ml 0.01 mol/L Ba(OH)2 溶液中滴入几滴酚酞溶液,然后向其中匀速逐滴加入2 ml 0.2 mol/L H2SO4溶液。

(1)实验过程中溶液中的现象为________、 ________。
(2)该反应的离子方程式是__________________。
(3)画出反应过程中溶液电导率变化示意图__________________。
(4)解释反应过程中溶液电导率出现上述变化的原因___。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,三种酸的电离平衡常数如下表所示。
化学式 |
|
|
|
名称 | 醋酸 | 次氯酸 | 亚磷酸 |
电离平衡常数 |
|
|
|
回答下列问题:
(1)pH相等的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液中,物质的量浓度最小的是____________(填化学式)。
溶液中,物质的量浓度最小的是____________(填化学式)。
(2)已知![]() 为正盐,依据表格数据,
为正盐,依据表格数据,![]() 的第二级电离平衡常数表达式
的第二级电离平衡常数表达式![]() ___________;25℃时,5.6mol·L-1
___________;25℃时,5.6mol·L-1![]() 溶液的pH=____________。
溶液的pH=____________。
(3)向体积均为10mL、![]() 均为
均为![]() mol·L-1的
mol·L-1的![]() 溶液和一元酸
溶液和一元酸![]() 溶液中,分别加水稀释至1000mL,稀释过程中
溶液中,分别加水稀释至1000mL,稀释过程中![]() 的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)
的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)![]() 的电离平衡常数,理由是______________________________。
的电离平衡常数,理由是______________________________。
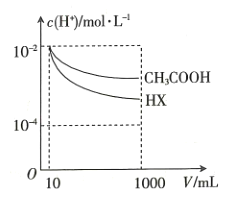
(4)常温下,将0.05mol·L-1的氨水逐滴加入10mL0.1mol·L-1![]() 溶液中至溶液显中性,此时溶液中各离子浓度大小关系为_________________。
溶液中至溶液显中性,此时溶液中各离子浓度大小关系为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学设计实验实现几种价态硫元素的转化。
任务I:从以下试剂中选择合适的试剂实现S (+6)→S(+4)的转化。
试剂清单:①浓H2SO4 ②稀H2SO4 ③酸性KMnO4溶液 ④Na2SO3溶液 ⑤Cu ⑥品红
(1)写出实现转化的化学方程式_______________
(2)设计实验,证明实现了该转化(写出操作和现象)_______________。
II:实现硫元素在0、+2、+4价之间的转化。
查阅资料:+2价硫在酸性条件下不稳定,易发生自身氧化还原反应。
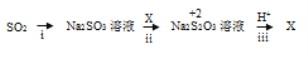
(3)i中加入的物质是__________ ,该转化利用的是SO2的_______性质。
(4)写出iii的离子方程式_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 反应过程的能量变化如图所示,请回答下列问题:
反应过程的能量变化如图所示,请回答下列问题:
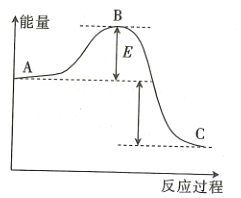
(1)该反应是______________(填“放热”或“吸热”)反应。
(2)用![]() 作该反应的催化剂,A、C两点的能量差是否变化?_____________(填“变化”或“不变”),理由是____________________。
作该反应的催化剂,A、C两点的能量差是否变化?_____________(填“变化”或“不变”),理由是____________________。
(3)在体积为2L的恒容密闭容器中通入2mol![]() 和3mol
和3mol![]() 发生上述反应,10min内
发生上述反应,10min内![]() 的物质的量变化如下表:
的物质的量变化如下表:
反应时间(min) | 0 | 3 | 5 | 7 | 10 |
| 0 | 0.2 | 0.3 | 0.38 | 0.38 |
①升高温度,反应速率______________(填“增大”或“减小”)。
②上述反应在7min时_______________(填“达到”或“未达到”)平衡状态。
③![]() min内,用
min内,用![]() 表示该反应的反应速率为_______________mol·L-1·min-1。
表示该反应的反应速率为_______________mol·L-1·min-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组同学对市售某种补铁口服液的成分进行探究。根据名称认为该糖浆中含有Fe2+,设计方案进行验证。

I.设计方案如下:
| 方案 | 试剂X | 预期现象 |
方案i | 1mL 1 mol/L NaOH溶液 | a | |
方案ii | 1mL 1 mol/L 酸性KMnO4溶液 | b | |
方案iii | 依次加入5滴KSCN溶液、1mL氯水 | c |
(1)方案i的预期现象是产生白色沉淀,逐渐变为灰绿色,最终变为红褐色。产生白色沉淀的离子方程式是_________,最终变为红褐色的化学方程式是________。
(2)方案ii的预期现象是_________。
(3)方案iii的预期现象是________,反应中氯水参与反应的的离子方程式是____。
II.进行实验操作,得到的实际现象如下:
方案 | 实际现象 | 是否与预期现象相同 |
方案i | 产生灰绿色浑浊,长时间不变红褐色 | 不同 |
方案ii | 相同 | |
方案iii | 自始至终无明显现象 | 不同 |
(4)为探究实验中出现异常现象的原因,该小组同学查看说明书,得知有关补铁口服液成分的如下:
本品每毫升含主要成分葡萄糖酸亚铁30毫克,
辅料为:蔗糖、香精、枸檬酸、羟苯乙酯。
结合资料对异常现象产生的原因进行猜想:______________;为验证其猜想,在方案iii的基础上继续加入过量的氯水,得到了预期的现象。
(5) 实验反思:方案ii中预期现象与实验现象相同,并不能证明补铁口服液中一定含有Fe2+,理由是______。
(6)小组同学进一步提出研究问题:仍选用之前用过的试剂,设计实验验证某久置的补铁口服液(计为Y
实验序号 | 操作 | 现象 |
ⅳ | 取2 mL溶液Y,加入1滴KSCN,再加入1 mL水 | 溶液显红色 |
V |
实验V的操作及现象是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下反应2AB(g)![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A. 单位时间内生成nmolA2,同时消耗2n molAB
B. 容器内,3种气体AB、A2、B2共存
C. AB的消耗速率等于A2的消耗速率
D. 容器中各组分的体积分数不随时间变化
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
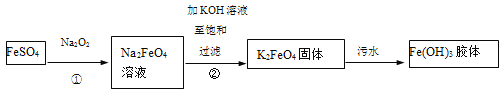
以下说法不正确的是
A.①中一定发生了氧化还原反应
B.污水处理中产生Fe(OH)3胶体,使悬浮物聚沉,利用了胶体具有较强吸附能力的特点
C.另一种在碱性条件下制备K2FeO4的反应可能是:2Fe(OH)3+3ClO-=2FeO42-+3Cl-+4H+ +H2O
D.K2FeO4还可以用于处理废水,例如可以把废水中的CN-转化为两种无毒气体,反应过程中,CN-做还原剂,被K2FeO4氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应:H2S(g)+ ![]() O2(g)=SO2(g)+H2O(g) △H1 ;2H2S(g)+SO2(g)=
O2(g)=SO2(g)+H2O(g) △H1 ;2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) △H2 ;H2S(g)+
S2(g)+2H2O(g) △H2 ;H2S(g)+ ![]() O2=S(g)+H2O △H3 ; 2S(g)=S2(g) △H4
O2=S(g)+H2O △H3 ; 2S(g)=S2(g) △H4
A. △H4=![]() (△H1+ △H2-3△H3)B. △H4=
(△H1+ △H2-3△H3)B. △H4=![]() (3△H3- △H1-△H2)
(3△H3- △H1-△H2)
C. △H4=![]() (△H1+△H2+3△H3)D. △H4=
(△H1+△H2+3△H3)D. △H4=![]() (△H1-△H2-3△H3)
(△H1-△H2-3△H3)
查看答案和解析>>
科目: 来源: 题型:
【题目】把浓盐酸分别滴入点滴板上的各种溶液中,现象如下:
实验 | 现象 |
| ①中溶液变蓝且无其他明显现象 |
②中无明显现象 | |
③中溶液褪色 | |
④中产生黄绿色气体 |
下列分析正确的是( )
A.①中现象体现了浓盐酸的氧化性
B.②中现象说明未发生反应
C.③中反应后氯元素全部以KCl形式存在
D.④中产生黄绿色气体的反应是:ClO-+ Cl-+ 2H+ = Cl2↑+ H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com