
科目: 来源: 题型:
【题目】某实验小组用0.5mol/L NaOH溶液和0.5mol/L硫酸溶液进行中和热的测定。
Ⅰ.准备仪器
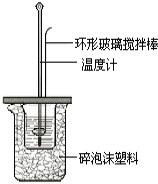
(1)环形玻璃搅拌棒__________(填“能”或“不能”)改为环形金属(如铜)棒,其原因是__________。
(2)碎泡沫的作用是______________,终止温度应为反应的最________(填“高”或“终”)温度。
II.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
(1)四次实验所得到的温度平均值为__________℃。
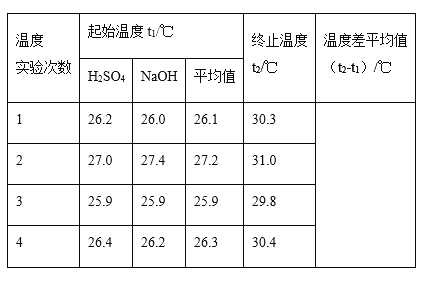
(2)取50mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如表。
①近似认为0.5mol/LNaOH溶液和0.5mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热△H =_____(取小数点后一位)。
②上述实验数值结果与573KJ·mol-1有偏差,产生偏差的原因可能是(填字母)_____。
a.实验装置保温、隔热效果差
b. 量取NaOH溶液的体积时仰视读数
c. 分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.反应时未用搅拌器搅拌
查看答案和解析>>
科目: 来源: 题型:
【题目】向100mL FeI2溶液中逐渐通入C12,其中n(I2)、n(Fe3+)随通入n(C12)的变化如图所示,下列说法不正确的是

A. 氧化性强弱:I2<Fe3+
B. n(Cl2)=0.12mol时,溶液中的离子主要有Fe2+、Fe3+、Clˉ
C. 由图可知,该FeI2溶液的浓度为1mol· L-l
D. n(C12):n(FeI2)=1:2时,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。不仅可以制备物质,还可以提纯和净化。
(1)电解食盐水是氯碱工业的基础。目前比较先进的方法是阳离子交换膜法,电解示意图如图所示,图中的阳离了交换膜只允许阳离子通过,请回答以下问题:
①图中A极要连接电源的_______(填“正”或“负”)极
②精制饱和食盐水从图中_____位置补充,氢氧化钠溶液从图中_____位置流出。(选填“a”“b” “c” “d” “e”或“f”)

③电解总反应的离子方程式是_____________。
(2)化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染,电化学降解NO3-的原理如图所示

①电源正极为____(填A或B),阴极反应式为_____________。
②若电解过程中转移了5mol电子,则膜左侧电解液的质量变化为__________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】锌钡白ZnS·BaSO4是一种常用白色颜料,以重晶石(BaSO4)和焦炭粉为原料,在回转炉中强热制取可溶性硫化钡。硫化钡在净化后形成溶液,再与硫酸锌经过一系列过程最终制得锌钡白成品。
(1)回转炉中发生反应的化学方程式为___________________________。
(2)回转炉尾气中含有有毒气体,生产上通入一定量的水蒸气进行处理,水蒸气的作用是_____________________________。
(3)成品中S2-的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L-1的I2-KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L-1Na2S2O3溶液滴定,反应式为I2+2S2O32-=2I-+S4O62-。测定时消耗Na2S2O3溶液体积V mL,滴定终点现象为__________,样品中S2-的含量为____________(写出表达式与计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】电化学与我们的生活有着密切的联系,请结合电化学知识回答下列有关问题:
(1)炒过菜的铁锅未及时洗浄(残液中含NaCl),不久便会因腐蚀而出现红褐色锈斑。试回答:铁锅的锈蚀应属于____________(填“析氢腐蚀”或“吸氧腐蚀”), 铁锅锈蚀的正极反应式为:____________。
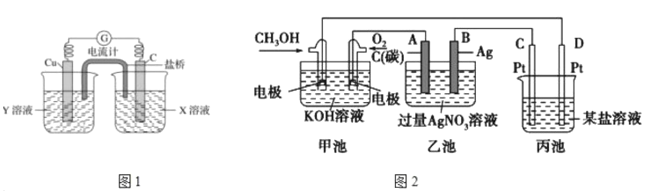
(2)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如上图1所示原电池,回答下列问题:
①写出正极电极反应式___________
②图中X溶液中的溶质是____________
(3)如图2是一个电化学反应的示意图。
①写出通入CH3OH的电极的电极反应式_______________
②乙池中总反应的离子方程式_____________
③熔融盐CH3OH燃料电池用熔融碳酸钾为电解质,则电池负极反应式__________
④当乙池中B(Ag)极的质量增加5.40g,若此时乙池中溶液的体积为500ml,则溶液H+的浓度是_____________;此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是_____(填序号)。
A. MgSO4 B. CuSO4 C. NaCl D. AgNO3
查看答案和解析>>
科目: 来源: 题型:
【题目】氰(CN)2、硫氰(SCN)2等称为拟卤素,它们与卤素单质性质相似,它们的阴离子也与卤素阴离子性质相似。例如:2Fe+3(SCN)2==2Fe(SCN)3、Ag++CN-== AgCN↓(白)。拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱,阴离子的还原性一般比Br-强。下列反应中,不正确的是( )
A. 2CN-+Cl2= 2Cl-+(CN)2
B. (CN)2+2OH-=CN-+CNO-+H2O
C. (SCN)2+H2O = 2H++SCN-+SCNO-
D. MnO2+4HSCN(浓)![]() (SCN)2↑+Mn(SCN)2+2H2O
(SCN)2↑+Mn(SCN)2+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以扑热息痛(对乙酰氨基苯酚)为原料,经多步反应制甘素的流程如下:
AcHNOH扑热息痛![]() 非那西汀
非那西汀![]() …
…![]() 甘素
甘素

步骤Ⅰ:非那西汀的合成
①将含有1.0 g扑热息痛的药片捣碎,转移至双颈烧瓶中。用滴管加入8 mL 1 mol/LNaOH的95%乙醇溶液。开启冷凝水,随后将烧瓶浸入油浴锅。搅拌,达沸点后继续回流15 min。
②将烧瓶移出油浴。如图所示,用注射器取1.0 mL的碘乙烷,逐滴加入热溶液中。继续将烧瓶置于油浴回流15 min。
③将烧瓶从油浴中抬起,取下冷凝管趁热用砂芯漏斗抽滤,滤去不溶的淀粉(药片的填充物)。将热滤液静置,得到沉淀。用另一个砂芯漏斗过滤得到非那西汀固体。
步骤Ⅱ:甘素的合成
①将非那西汀固体转移到圆底烧瓶中,加入5 mL 6 mol/L盐酸。加热回流15 min。
②加入NaHCO3调至pH为6.0~6.5,再向反应液中加1.37 g尿素和2滴乙酸。加热回流60 min。
③移出烧瓶,冷却,有沉淀析出,抽滤,用冰水洗涤,得到甘素。
(1)将药片捣碎所用的仪器名称为________________。
(2)实验中用油浴加热的优点是______________________。
(3)使用砂芯漏斗抽滤的优点是_________________且得到的沉淀较干燥。
(4)冷凝管的冷却水从________(填“a”或“b”)端进。
(5)步骤Ⅱ中向热溶液中加入NaHCO3中和,为避免大量CO2逸出,加入NaHCO3时应__________________。
(6)用冰水洗涤甘素固体的操作是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】锌的配合物[Zn(NH3)4]2+、ZSM、[Zn(N2H4)2(N3)2] n等用途非常广泛。
(1)Zn2+基态核外电子排布式为________________________。
(2)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配体NH3分子属于________(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键___________。

(3)ZSM是2-甲基咪唑和水杨酸与锌形成的配合物,2-甲基咪唑可通过下列反应制备:

①与CN-互为等电子体的分子是____________(填化学式,写两种)。
②2-甲基咪唑中碳原子杂化轨道类型为________;1 mol 2-甲基咪唑分子中含σ键和π键之比为________。
③乙二胺易溶于水的主要原因是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)某种粒子有1个原子核,核中有17个质子,20个中子,核外有18个电子,该粒子的化学符号是__。
(2)下列关于化学键的说法正确的是____。
① 含有金属元素的化合物一定是离子化合物
② 第IA族和第ⅦA族元素原子化合时,一定生成离子键
③ 由非金属元素形成的化合物一定不是离子化合物
④ 活泼金属与非金属化合时,能形成离子键
⑤ 离子键就是阴、阳离子间的相互引力
⑥离子化合物中可能含有非极性共价键
(3)写出下列物质的电子式:Mg(OH)2:____, N2:_______,NH4I:_______。
(4)用电子式表示下列化合物的形成过程:Na2S:_______;H2O:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】许多含氮物质会造成环境污染,硝酸工业的尾气(含NO、NO2)会造成大气污染,通常用选择性非催化还原法或碱液吸收法[石灰乳吸收,既能净化尾气,又能获得应用广泛的Ca(NO2)2]。而废水中过量的氨氮(NH3和NH4+)会导致水体富营养化,则通常用强氧化剂来吸收。
(1)废气中氮氧化物的吸收。
①选择性非催化还原法。发生的主要反应有:
4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH=-1646 kJ·mol-1
4N2(g)+6H2O(g) ΔH=-1646 kJ·mol-1
2NO(g)+(NH2)2CO(s)+![]() O2(g)
O2(g)![]() 2N2(g)+2H2O(g)+CO2(g) ΔH=-780.02 kJ·mol-1
2N2(g)+2H2O(g)+CO2(g) ΔH=-780.02 kJ·mol-1
则2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)的ΔH=__________。
CO(NH2)2(s)+H2O(g)的ΔH=__________。
②碱液吸收法。该工艺中采用气液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),得到的滤渣可循环使用,该滤渣的主要成分是________(填化学式)。 工艺需控制NO和NO2物质的量之比接近__________,若小于这个比值,则会导致_______________。
(2)废水中过量的氨氮(NH3和NH4+)处理。某科研小组用NaClO氧化法处理氨氮废水。
已知:A.HClO的氧化性比NaClO强;
B.NH3比NH4+更易被氧化;
C.国家标准要求经处理过的氨氮废水pH要控制在6~9。
进水pH对氨氮去除率的影响如下图所示。
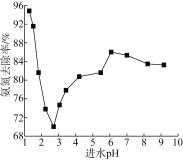
①进水pH为2.75~6.00范围内,氨氮去除率随pH升高而上升的原因是___________。
②写出酸性条件下ClO-氧化NH4+的离子方程式____________________。
③已知a.O2的氧化性比NaClO弱; b.O2氧化氨氮速率比NaClO慢。
在其他条件不变时,仅增加单位时间内通入空气的量,氨氮去除率_______________(填“显著变大”“显著变小”或“几乎不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com