
科目: 来源: 题型:
【题目】用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )
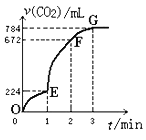
A.F点收集到的CO2的量最多
B.OE段表示的平均速率最快
C.EF段用盐酸表示该反应的平均反应速率为0.4mol·L-1min-1
D.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7
查看答案和解析>>
科目: 来源: 题型:
【题目】已知氨气可与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置![]() 省略夹持装置
省略夹持装置![]() 可以实现该反应,实验时C中粉末逐渐变为红色,D中出现无色液体。下列有关说法正确的是
可以实现该反应,实验时C中粉末逐渐变为红色,D中出现无色液体。下列有关说法正确的是

A.试管A中加入的试剂为![]() 固体
固体
B.反应中氧化剂和还原剂的物质的量之比为![]()
C.装置B中加入的物质可以是碱石灰或无水氯化钙
D.装置D中液体可以使干燥的红色石蕊试纸变蓝
查看答案和解析>>
科目: 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
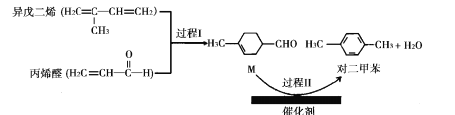
下列说法不正确的是
A.丙烯醛分子中所有原子可能共平面B.可用溴水鉴别异戊二烯和对二甲苯
C.对二甲苯的二氯代物有6种D.M能发生取代,加成,加聚和氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】一种双室微生物燃料电池污水净化系统原理如图所示,图中酸性污水中含有的有机物用C6H12O6表示。下列有关该电池的说法不正确的是( )
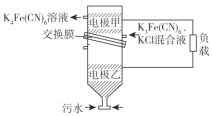
A.正极的电极反应为Fe(CN)63-+ e- =Fe(CN)64-
B.电池的总反应为C6H12O6 + 24Fe(CN)63-+6H2O=6CO2↑+Fe(CN)64-+24H+
C.该“交换膜”可选用“质子交换膜”
D.若将“K4Fe(CN)6溶液”改为“O2”,当有22.4L O2参与反应时,理论上转移4mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献。如图为联合制碱法的主要过程(部分物质已略去)。
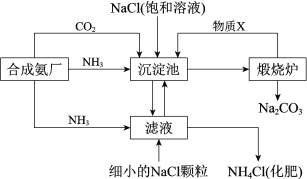
资料:ⅰ.沉淀池中的反应为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
ⅱ.溶解度
物质 | NaCl | NH4HCO3 | NaHCO3 | NH4Cl |
20°C溶解度/g | 36.0 | 21.7 | 9.6 | 37.2 |
(1)煅烧炉中反应的化学方程式是___,物质X是___(填化学式)。
(2)下列说法正确的是__(填字母)。
A.沉淀池中有NaHCO3析出,因为一定条件下NaHCO3的溶解度最小
B.滤液中主要含有NaCl、Na2CO3和NH4Cl
C.设计循环的目的是提高原料的利用率
(3)工业可用纯碱代替烧碱生产某些化工产品,如用饱和纯碱溶液与Cl2反应可制得一种在生产生活中常用于漂白、消毒的物质,同时有NaHCO3生成,该反应的化学方程式是___。
(4)某纯碱样品中含杂质NaCl,取质量为ag的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到bg固体物质,则此样品中Na2CO3的质量分数为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】LDFCB是锂离子电池的一种电解质,该电解质阴离子由同周期元素W、X、Y、Z构成(如下图),Y的最外层电子数等于X的核外电子总数,四种元素最外层电子数之和为20。下列说法正确的是( )
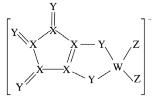
A.四种元素的单质中,Z的沸点最高
B.原子半径∶W>X>Y>Z
C.W、Z形成的分子中各原子均满足8电子稳定结构
D.Y分别与另外三种元素形成的二元化合物中,Y的价态相同
查看答案和解析>>
科目: 来源: 题型:
【题目】类比推理是化学中常用的思维方法。下列推理正确的是
A.lmol晶体硅含Si-Si键的数目为2NA,则1mol金刚砂含C-Si键的数目也为2NA
B.Ca(HCO3)2溶液中加入过量的NaOH溶液,发生化学反应的方程式:![]()
则Mg(HCO3)2溶液中加入过量的NaOH溶液,发生化学反应的方程式: ![]()
C.标准状况下,22.4 L CO2中所含的分子数目为NA个,则22.4 LCS2中所含的分子数目也为NA个
D.NaClO溶液中通人过量CO2发生了反应:![]() ,则Ca(ClO)2溶液中通入过量CO2发生了:
,则Ca(ClO)2溶液中通入过量CO2发生了:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某烃的含氧衍生物可以作为无铅汽油的抗爆震剂,它的相对分子质量不超过100,含C的质量分数为68.2%,含H的质量分数为13.6%,其余为氧。请计算回答:
(1)该化合物的相对分子质量是____________________。
(2)写出该化合物的分子式___________________________。
(3)若该化合物不能与钠反应产生氢气,红外光谱和核磁共振氢谱显示该分子中有4个甲基。请写出其结构简式。_________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】焦锑酸钠(NaSbO3·3H2O)可用于搪瓷的乳白剂及铁皮、钢板的抗酸漆。一种利用高砷锑烟灰(主要成分为Sb2O3、As2O3,还含Ag、Cu、Fe的氧化物)生产焦锑酸钠的工艺流程如下:
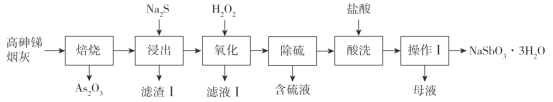
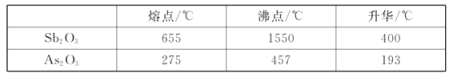
已知:i.Sb2O3、As2O3部分性质如下表:
ii.Ag、Cu、Fe的氧化物不溶于Na2S溶液
iii.Na2SbO4不溶于水;NaSbO3﹒3H2O既不溶于水,也不溶于酸。
请回答下列问题:
(1)“焙烧”的最低温度为_________(填标号)
a.655℃ b.400℃ c.275℃ d.193℃
(2)“浸出”时,往往采取比常温稍高的浸液温度,且选用较高浓度的Na2S溶液,采取这些措施的目的是_________________________________________。“浸出”时,Sb2O3转化为Na3SbS3的化学方程式为__________________________________________,滤渣Ⅰ是____________。
(3)“氧化”时所用H2O2的电子式为___________,氧化产物为Na3SbO4和____________.
(4)“酸洗”的作用是______________________。(用化学方程式表示)
(5)As2O3对应的酸为H3AsO3,测得某工业酸性废液中含H3AsO3和Fe2+,其浓度如表:

已知:iV.Ksp(FeAsO3)>Ksp(FeAsO4)=5.70×10-21。
V.H3AsO3的还原性比Fe2+强。
根据题目信息,则可采用______________方法除去该废水中的砷,除去砷后的废液中c(AsO43-)=__________________(不考虑反应过程中溶液体积的微小变化)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A是一种常见金属,部分反应物或生成物已略去。试根据图中转化关系,回答下列问题。
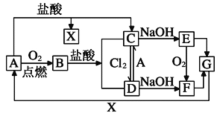
(1)B的俗名为____。
(2)保存C溶液时需加入少量A的原因是____,A与水蒸气反应的化学方程式为____,该反应类型属于____(填基本反应类型)
(3)E生成F可观察到的现象____,化学方程式为____。
(4)写出B→C化学方程式为____,C→D的离子方程式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com