
科目: 来源: 题型:
【题目】从接触法制硫酸的废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | VOSO4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
一种废钒催化剂回收工艺路线流程如下:
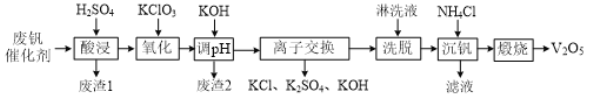
回答下列问题:
(1)“酸浸”时为了提高钒元素的浸出率,可以采取的措施是______。
(2)“酸浸”时可以得到![]() 和VO2+,“氧化”时VO2+转化为
和VO2+,“氧化”时VO2+转化为![]() 的离子方程式为______。
的离子方程式为______。
(3)“调pH”后钒以![]() 形式存在于溶液中。“废渣2”所含成分的化学式为____。
形式存在于溶液中。“废渣2”所含成分的化学式为____。
(4)“离子交换”和“洗脱”的过程可表示为:4ROH+![]()
![]() R4V4O12+4OH (ROH为某种碱性阴离子交换树脂)。流程中进行“离子交换”和“洗脱”的目的是______。
R4V4O12+4OH (ROH为某种碱性阴离子交换树脂)。流程中进行“离子交换”和“洗脱”的目的是______。
(5)“沉钒”时得到偏钒酸铵(NH4VO3)沉淀。
①检验偏钒酸铵沉淀是否洗涤干净的方法是______。
②“煅烧”中发生反应的化学方程式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验装置及操作均正确的是
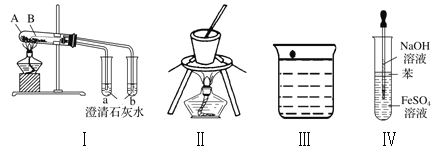
A. 图I中A盛放碳酸氢钠,B盛放碳酸钠,可对比二者的热稳定性
B. 图II可用于在碳酸钠溶液中提取碳酸钠固体
C. 图III为钠与水的反应现象探究实验的装置
D. 图IV为实验室制备观察氢氧化亚铁的装置
查看答案和解析>>
科目: 来源: 题型:
【题目】现往体积固定的密闭容器中通入等物质的量的NO2和CO,反应中的CO和NO的浓度随时间变化的示意图如图。根据图意回答下列问题:
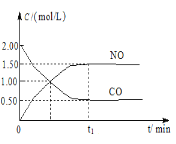
(1)从反应开始到平衡,用NO2浓度变化表示平均反应速率υ(NO2)=___。
(2)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H<0。试回答:
CO2(g)+H2(g)△H<0。试回答:
①若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____。
②在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1,则此时该反应是否达到平衡状态___(填“是”与“否”),此时υ(正)__υ(逆)(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】完成下列与溶液pH有关的计算
(1)室温下pH=2的HCl溶液和pH=10的NaOH溶液中由水电离出的c(H+)之比为____。
(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,溶液中的氢离子浓度为__。
(3)某温度时,水的KW=10-13,将此温度下pH=12的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得混合溶液pH=3,则a:b=___。
(4)已知某温度时0.1molL-1NaOH pH等于11,在此温度下,若将100体积pH1=a的H2SO4溶液与1体积pH2=b的NaOH溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是___(用含a、b的表达式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl)是一种重要的化工原料,常用作催化剂、杀菌剂。化学小组用如图装置(部分夹持装置略去)制备氯化亚铜。
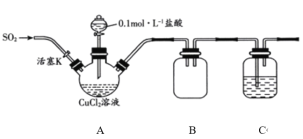
已知:①氯化亚铜是一种白色固体,能溶于氨水,微溶于水,不溶于酒精;在空气中会被迅速氧化。
②在酸性条件下,某些中间价态的离子能发生自身氧化还原反应。
实验步骤:
I.打开分液漏斗活塞,向三颈瓶中加盐酸调pH至2~3。打开活塞K,通入SO2,溶液中产生白色沉淀,待反应完全后,再通一段时间的气体。
II.将反应混合液过滤、洗涤、干燥得CuCl粗产品,纯化后得CuCl产品。
回答下列问题:
(1)装置B的作用是________。
(2)步骤I中通入SO2发生反应的离子方程式是________。
(3)步骤II中采用抽滤法过滤的主要目的是________;用95%的乙醇代替蒸馏水洗涤的优点是________。
(4)化学小组同学在实验过程中,将分液漏斗中的0.lmolL-1盐酸换为6molL-1盐酸,通入SO2,最终未得到白色沉淀。
①对此现象有如下猜想:
猜想一:Cl-浓度过大,与CuCl发生反应
小组同学对猜想一的原理进行深入研究,查阅资料知:CuCl+Cl-CuCl2-,据此设计实验:将上述未得到沉淀的溶液_____(填操作),若观察到有白色沉淀析出,证明猜想一正确。
②猜想二:________。
设计验证猜想二是否成立的实验方案________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题。
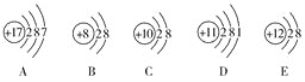
①与离子相对应的元素符号是______________,与原子相对应的离子的结构示意图是______________。
②电子层结构相同的是__________(填写代号,下同),性质最稳定的是__________,最容易失去电子的是__________,最容易得到电子的是__________。
③可直接相互结合形成的化合物的化学式是____________。可经过得失电子后再相互结合形成的化合物的化学式是______________。
④在核电荷数1~10的元素内,列举两个与B电子层结构相同的离子,写出离子的符号______________。
(2)已知元素X和Y的核电荷数均小于18,最外层电子数分别为n和(m-5),次外层有(n+2)个和m个电子,据此推断元素X和Y,其名称为X__________,Y__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室有一未知浓度的盐酸,某同学在实验室中进行实验测定盐酸的浓度。请完成下列填空:
配制100mL0.10molL-1NaOH标准溶液。取20.00mL待测盐酸放入锥形瓶中,滴加 2~3滴酚酞作指示剂,用配制的标准 NaOH溶液进行滴定。重复上述滴定操作 2~3次,记录数据如下:
滴定次数 | 待测盐酸的体积/mL | 0.10 mol/L NaOH 溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 20.00 | 2.00 | 28.15 |
第二次 | 20.00 | 1.50 | 29.50 |
第三次 | 20.00 | 0.20 | 26.55 |
①该实验滴定达到终点的标志是____
②根据上述数据,可计算出该盐酸的浓度约为___。(保留两位有效数字)
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有____。(双选)
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
E.称量NaOH 固体时,混入少量KOH杂质
④现用以上实验配制的0.10molL-1NaOH溶液滴定未知浓度的CHCOOH溶液,反应恰好完全时,下列叙述中正确的是___
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D四种元素,A的最高正价与其最低负价的绝对值之差为6;A、D次外层都是8个电子,A与D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子;B有两个电子层,其最高正价与最低负价的代数和为0;C2-与氩原子具有相同的电子层结构。
(1)试写出上述各元素的符号:A______,B______,C______,D______。
(2)画出下列粒子的结构示意图:A:________________,C2-:__________。
(3)元素A、C、D形成简单离子的半径由大到小的顺序是________________。
(4)写出A、D的最高价氧化物对应水化物反应的化学方程式:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com