
科目: 来源: 题型:
【题目】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
醋酸 | 碳酸 | 亚硫酸 |
Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)写出碳酸的第二步电离平衡常数表达式![]() _____________
_____________
(2)在相同条件下,试比较醋酸、碳酸和亚硫酸的酸性强弱____ > ____ > ____。____
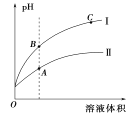
(3)图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液pH随水量的变化:
①图像中,曲线I表示的酸是____(填化学式)。
②A、B、C三点中,水的电离程度最大的是____(填字母)
(4)同c(H+)同体积的的醋酸和盐酸溶液分别用氢氧化钠中和,所需氢氧化钠物质的量较大的是 _________________________.
(5)下列粒子组不能大量共存的是_____________________________。
A. H2SO3、HCO3- B. HSO3-、CO32- C.HSO3-、HCO3- D. HCO3-、SO32- E.H2SO3、CO32- F. H 2SO3、SO32- G. H2CO3、HSO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】消除尾气中的NO是环境科学研究的热点课题。
I.NO氧化机理
已知:2NO(g)+O2(g) ![]() 2NO2(g)△H=-110kJ·mol-1
2NO2(g)△H=-110kJ·mol-1
25℃时,将NO和O2按物质的量之比为2:1充入恒容反应容器中,用测压法研究其反应的进行情况。体系的总压强p随时间t的变化如下表所示(忽略NO2与N2O4的转化)
t/min | 0 | 80 | 160 |
|
p/kPa | 75.0 | 63.0 | 55.0 | 55.0 |
(1)0~80min,v(O2)=_____kPa/min;随着反应进行,反应速率逐渐减小的原因是______________。
用平衡分压代替平衡浓度所得到的平衡常数用K(p)表示,25℃时,K(p)的值为_______(保留3位有效数字)。
(2)查阅资料,对于总反应2NOg)+O2(g) ![]() 2NO2(g)有如下两步历程
2NO2(g)有如下两步历程
第一步2NO(g) ![]() N2O2(g) 快速反应
N2O2(g) 快速反应
第二步N2O2(g)+O2(g) ![]() 2NO2(g) 慢反应
2NO2(g) 慢反应
总反应速率主要由第_____步决定;若利用分子捕获器适当减少反应容器中的N2O2,总反应的平衡常数K(p)将___(填“增大”、“减小”或“不变”);若提高反应温度至35℃,则体系压强P(35℃)______P(25℃)(填“大于”、“等于”或“小于”)。
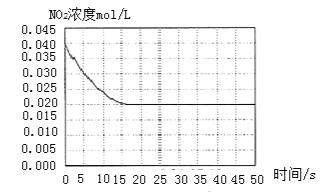
II. 某温度下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如上图所示。
(1)反应体系达平衡后压强为P1,若升高温度,再次达平衡后,混合气体的平均相对分子质量______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() ;
;
(2)若在恒温恒容条件下,向平衡体系中充入一定量O2,再次达平衡后,测得压强为P2,c(O2)=0.09mol/L,则P2:P1=______
(3)该温度下反应2NO(g)+O2(g) ![]() 2NO2(g)的化学平衡常数K为______。
2NO2(g)的化学平衡常数K为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】钒和五氧化二钒在工业应用中广泛,某工厂从钒渣中回收金属,钒渣中主要成分有V2O3、FeO,还含有少量的CuO、Al2O3,工艺流程如图:
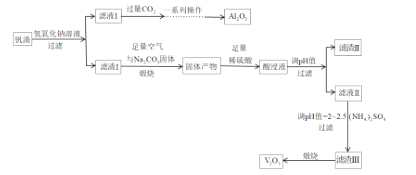
已知:①KspCu(OH)2=1.0×1021;KspFe(OH)3=4.0×1038;KspFe(OH)2=8.0×1016。
②NH4VO3难溶于水,(VO2)2SO4易溶于水。
(1)写出滤液I中加入过量的CO2时发生反应的离子方程式;制取纯净的Al2O3需要经过一系列操作:过滤、___、___。
(2)煅烧时,滤渣I的主要成分V2O3转化为可溶性NaVO3,写出其反应的化学方程式___。
(3)加入稀硫酸后,酸浸液中VO3与VO2+能大量共存的原因是___(用离子方程式解释)。
(4)常温下调节酸浸液的pH=___,即可以完全除去铁、铜两种元素对应的离子___;实际pH值要调整到8,其目的是___;调pH=2~2.5后过滤,滤渣III的主要成分为___。
(5)请写出煅烧滤渣III时,发生反应的化学方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上60%的镁来自海水,从海水中提取镁工艺流程如图所示,下列说法正确的是( )
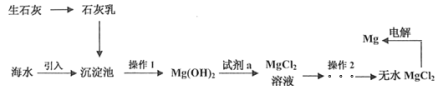
A.该工艺流程涉及的反应有分解反应、化合反应和置换反应
B.操作1为过滤,实验室里为加快过滤速度应用玻璃棒搅拌液体
C.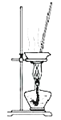 操作2实验室可用该装置对MgCl2溶液进行蒸发浓缩,再冷却结晶获得无水MgCl2
操作2实验室可用该装置对MgCl2溶液进行蒸发浓缩,再冷却结晶获得无水MgCl2
D.该工艺的优点是原料来源广泛,同时获得重要的化工原料氯气
查看答案和解析>>
科目: 来源: 题型:
【题目】一种从乙醛工业中产生的废钯(Pd)催化剂(钯5-6%,炭93-94%,铁、铜、锌、镍1-2%)中提取PdCl2和CuCl2的工艺流程如图所示:
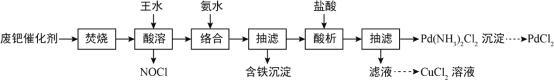
已知:钯、铜、锌、镍可与氨水形成Pd(NH3)42+等络离子。请回答:
(1)“焚烧”的主要目的为______________,实验室中可在______________(填仪器名称)中模拟该过程。
(2)“酸溶”时,Pd转化为PdCl2,其化学方程式为______________;该过程需控温70-80℃,温度不能太低或太高的原因为______________。
(3)“络合”时,溶液的pH需始终维持8-9,则络合后溶液中含铁离子的浓度≦______________。(已知:Fe(OH)2、Fe(OH)3的Ksp甲分别为4×10-17、2.8×10-39)
(4)“酸析”时生成沉淀的离子方程式为______________。
(5)流程中回收得到的PdCl2和CuC12在乙烯直接氧化制乙醛的催化体系中联合发挥作用,反应机理如下:
i.![]() ;
;
ii.______________;
iii.![]() 。
。
ii的化学方程式为______________。
(6)上述提取PdCl2和CuCl2方案的缺点是______________(写出一条即可)。
查看答案和解析>>
科目: 来源: 题型:
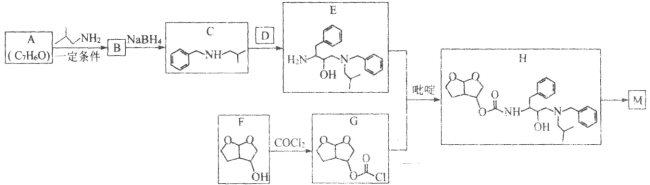
【题目】化合物M(![]() )是一种能有效抑制新型冠状病毒复制的药物中间体。实验室以芳香化合物A为原料制备M的一种合成路线如图所示:
)是一种能有效抑制新型冠状病毒复制的药物中间体。实验室以芳香化合物A为原料制备M的一种合成路线如图所示:
已知:①![]() R1
R1![]() N
N![]() R2(R1、R2表示氢原子或烃基)
R2(R1、R2表示氢原子或烃基)
②![]()
![]() NR1R2
NR1R2
请回答:
(1)A的化学名称为______________;B的结构简式为______________;D中含氧官能团的名称为______________。
(2)F→G的化学方程式为______________。
(3)由E和G生成H的反应类型为______________;吡啶是一种有机碱,该反应中加入吡啶的作用为______________。
(4)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳原子。M中含有手性碳原子的数目为______________。
(5)C的同分异构体中,属于芳香族化合物且核磁共振氢谱中有4组峰的结构简式为______________(任写2种即可)。
(6)写出用乙醇和乙胺(CH3CH2NH2)为原料制备化合物![]() NH
NH![]() 的合成路线______________(其他无机试剂任选)。
的合成路线______________(其他无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列操作或叙述正确的是( )
A.向无色溶液中加入BaCl2溶液有白色沉淀出现,再加盐酸沉淀不消失,该溶液中一定含有SO42-
B.向某溶液中加入浓氢氧化钠溶液并加热,用湿润的红色石蕊试纸进行如图所示操作来检验溶液中是否存在NH4+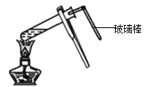
C.将某固体试样完全溶于盐酸,再滴加KSCN溶液,没有出现血红色,该固体试样中也可能存在Fe3+
D.向无色溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体,则该溶液中一定含有CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】化学小组在验证反应“![]() ”的实验中检测到Fe3+,发现和探究过程如下:
”的实验中检测到Fe3+,发现和探究过程如下:
向硝酸酸化的0.05mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,静置片刻,烧杯底部有黑色固体,溶液呈黄色。
(1)探究反应产物
①取上层清液,滴入酸性高锰酸钾溶液中,溶液紫色褪去,说明溶液中含有的离子是________(写化学式)。
②取少量黑色固体,洗涤后,加稀硝酸溶解固体,再加盐酸,观察到________,证明黑色固体中含有Ag。
(2)对“溶液呈黄色”进行探究
①甲认为溶液中有Fe3+;乙认为铁粉过量时不可能有Fe3+,乙的理由是________(用离子方程式表示)。
②对Fe3+产生的原因作出如下假设:
假设Ⅰ:空气中的O2将Fe2+氧化;
假设Ⅱ:酸性溶液中![]() 具有氧化性,将Fe2+氧化;
具有氧化性,将Fe2+氧化;
假设Ⅲ:溶液中的________将Fe2+氧化。
③实验验证:
ⅰ.向硝酸酸化的NaNO3溶液(pH≈2)中加入过量铁粉,搅拌后静置,取不同时间的上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后,溶液几乎无色。
ⅱ.向ⅰ中所得上层清液中加入________溶液,有黑色固体析出,向上层清液中滴加KSCN溶液,溶液变红。
④综合上述实验得知,假设________(填序号)正确,氧化Fe2+的离子方程式是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜是人类知道最早的金属之一,也是广泛使用的第一种金属。回答下列问题:
(1)镍白铜(铜镍合金)可用于制作仿银饰品。第二电离能I2(Cu)______________Ⅰ2(Ni)(填“>"或 “<”),其原因为______________。
(2)向[Cu(NH3)2]Cl溶液中通入乙炔(C2H2)气体,可生成红棕色沉淀Cu2C2。
①C2H2分子中![]() 键与
键与![]() 键的数目之比为______________;碳原子的杂化方式为______________。
键的数目之比为______________;碳原子的杂化方式为______________。
②写出与Cu2C2中阴离子C22-互为等电子体的一种分子和一种离子______________。
(3)乙二胺(H2N-CH2CH2-NH2)易与Cu2+形成络合物用于Cu2+的定量测定。
①形成的络合物中提供孤对电子的原子为______________(填元素符号)。
②乙二胺中所含元素的电负性由大到小的顺序为______________;乙二胺在水中溶解度较大的原因为______________。
(4)铜与氧构成的某种化合物的立方晶胞如图a所示,图b是沿晶胞对角面取得的截图,晶胞中所有原子均在对角面上。氧原子的配位数为______________,若Cu原子之间最短距离为dpm,阿伏加德罗常数的值为NA,该晶体的密度为______________g·cm-3(列出计算式即可)。
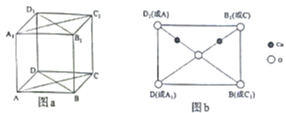
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)现有下列物质 ①NaCl晶体②液态SO2③冰醋酸④硫酸钡⑤铜⑥酒精(C2H5OH)⑦熔化的KCl⑧NaOH溶液⑨氯水⑩纯盐酸,请用以上物质回答下列问题。
属于强电解质且在上述状态下能导电的是____________;属于弱电解质的是_____________; 属于非电解质,但溶于水后的水溶液能导电的是______________。
(2)在密闭容器中,使1 mol N2和3 mol H2混合发生下列反应:N2 (g)+3H2 (g)![]() 2NH3 (g) ΔH <0。
2NH3 (g) ΔH <0。
①达到平衡时, 充入N2并保持体积不变,平衡将______移动(填“正向”、“逆向”或“不”)。
②达到平衡时,充入氩气(Ar)并保持体积不变,平衡将______移动(同上)。
③达到平衡时,充入氩气(Ar),并保持压强不变,平衡将______移动(同上)。
④达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡______移动(同上)。
⑤保持体积不变,升高温度时,混和气体的平均相对分子质量______,密度_______(填“变大”、“变小”或“不变”)。
⑥当反应达到平衡时,N2和H2的浓度比是______;N2和H2的转化率比是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com