
科目: 来源: 题型:
【题目】前四周期的A、B、C、D、E五种元素,原子序数逐渐增大。A元素核外有三个电子层,最外层电子数是核外电子总数的1/6;B元素核外只有一个未成对电子,能与水剧烈反应;C元素正三价离子的3d轨道为半充满状态;D元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;E元素的价电子构型为nsanpa+1,其某种氧化物有剧毒。
(1)A元素的第一电离能___Al元素的第一电离能(填“<”“>”或“=”),请解释原因___。
(2)写出B2O2与H2O反应过程中断裂的化学键的种类___。
(3)C元素位于元素周期表的___区,它的价电子排布式是___,C(CO)x的中心原子价电子数与配位数提供的电子数之和为18,则x=___。
(4)D2O的熔点比D2S的熔点高,其原因是___。
(5)ECl3分子的立体构型为___,其中E的杂化类型为___,E元素可能的性质为___(从下列选项中选择)。
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
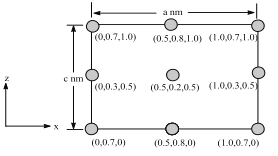
(6)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。BSiAl3O7属于正交晶系(长方体形),晶胞参数为anm、bnm、cnm。如图为沿y轴投影的晶胞中所有B原子的分布图和原子分数坐标。据此推断该晶胞中B原子数目为___;BSiAl3O7的摩尔质量为Mgmol-1,设NA为阿伏伽德罗常数的值,则晶体的密度=___(gcm3)。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳元素形成的有机化合物在动植物体内及人类生存环境中有着相当广泛的存在,起着非常重要的作用。请结合下列有关含碳化合物的研究,完成下列填空。
(1)为了高效利用能源并且减少CO2的排放,可用下列方法把CO2转化成甲醇燃料:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=akJmol1
②2H2(g)+O2(g)=2H2O(g) △H=bkJmol1
③CH3OH(g)=CH3OH(l) △H=ckJmol1
④H2O(g)=H2O(l) △H=dkJmol1
则表示CH3OH(l)燃烧热的热化学方程式为___。
(2)用甲醇燃料电池电解处理酸性含铬废水(主要含有Cr2O72),用如图装置模拟该过程:
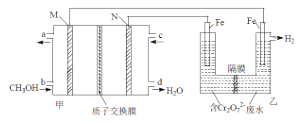
①请完成电解池中Cr2O72转化为Cr3+的离子方程式___。
②当甲池中消耗甲醇1.6g时,乙池中两电极的质量差为___g。
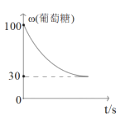
(3)葡萄糖和果糖为同分异构体,在一定条件下,C6H12O6(葡萄糖)![]() C6H12O6(果糖) △H﹤0。该反应的速率方程式可表示为v(正)=k(正)c(葡)、v(逆)=k(逆)c(果),k(正)和k(逆)在一定温度下为常数,分别称作正、逆反应速率常数。T1温度下,k(正)=0.06s1,k(逆)=0.002s1。
C6H12O6(果糖) △H﹤0。该反应的速率方程式可表示为v(正)=k(正)c(葡)、v(逆)=k(逆)c(果),k(正)和k(逆)在一定温度下为常数,分别称作正、逆反应速率常数。T1温度下,k(正)=0.06s1,k(逆)=0.002s1。
①T1温度下,该反应的平衡常数K1=___。
②该反应的活化能Ea(正)___Ea(逆)(填“大于”、“小于”或“等于”)。
③该T2温度下,从开始反应到平衡的过程中,葡糖糖的质量分数变化如图所示。可以确定温度T2___T1(填“大于”、“小于”或“等于”)。
(4)H2A为二元弱酸。室温下配制一系列c(H2A)+c(HA)+c(A2)=0.100molL1的H2A与NaOH的混合溶液。测得H2A、HA、A2的物质的量分数c(x)%(c(x)%=![]() ×100%)随pH变化如图所示。
×100%)随pH变化如图所示。
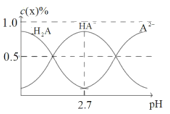
①当c(Na+)=0.100molL1时,溶液中离子浓度的大小顺序为___。
②室温下,若将0.100molL1的H2A与amolL1的NaOH溶液等体积混合,使溶液的pH=7。则H2A的Ka2=___molL1(用a表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将0.1molL1的NaOH溶液逐渐加到5mL0.1molL1的一元酸HA溶液中,测得混合溶液的BG(BG=-lg![]() )与所加NaOH的体积的变化关系如图所示。
)与所加NaOH的体积的变化关系如图所示。
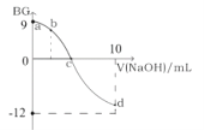
下列叙述错误的是( )
A.该滴定过程可选用酚酞做指示剂
B.c点所加的NaOH溶液的体积小于5mL
C.从a点到c点,水的电离程度一直增大
D.若b点所加的NaOH溶液的体积等于2.5mL,则所得溶液中:c(H+)=c(HA)+c(OH)+c(Na+)
查看答案和解析>>
科目: 来源: 题型:
【题目】某澄清透明的溶液中可能含有:Na+、Mg2+、Fe2+、Cu2+、I-、CO32-、SO42-、Cl-中的几种,各离子浓度均为0.1 mol·L-1。现进行如下实验(所加试剂均过量):
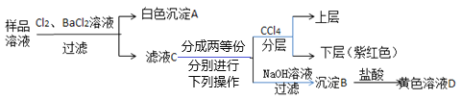
下列说法正确的是( )
A.样品溶液中肯定存在Na+、Fe2+、I、SO42
B.沉淀B中肯定有氢氧化铁,可能含有氢氧化镁
C.取1 L黄色溶液D能恰好溶解铁1.4 g
D.该样品溶液中是否存在Cl-可取滤液C,滴加硝酸银和稀硝酸进行确定
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,在pH=5的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
A.加入水时,平衡向右移动,CH3COOH电离常数增大
B.加入少量CH3COONa固体,平衡向右移动
C.加入少量NaOH固体,平衡向右移动,c(H+)减小
D.加入少量pH=5的硫酸,溶液中c(H+)增大
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,下列说法正确的是( )
A.将pH=2的盐酸和pH=4的硫酸等体积混合,所得溶液pH=3
B.HF比HCN易电离,则HF溶液的导电能力比HCN溶液的大
C.向0.1mol/L氨水中加入少量硫酸铵固体,溶液中![]() 增大
增大
D.将1mLpH=3的HA溶液稀释到10mL,若溶液的pH<4,则HA为弱酸
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D为石墨电极,E、F分别为短周期相邻的两种活泼金属中的一种,且E能与NaOH溶液反应。按图接通线路,反应一段时间,当电路中通过1.0×10-3mol电子时,下列叙述正确的是( )
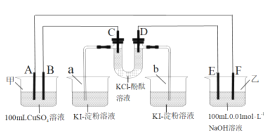
A.U型管中的D端先变红,b烧杯中的溶液会变蓝
B.a烧杯中最多有0.127gI2(KI足量)生成,甲池中的质量会减少0.04g(CuSO4溶液足量)
C.A极产生气体的体积为5.6mL,甲池溶液的pH值为2
D.E电极附近的溶液无明显现象产生
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25 ℃时0.1 mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
C.NaHCO3溶液中溶质的电离方程式为NaHCO3===Na++H++CO![]()
D.室温下,对于0.10 mol·L-1的氨水,加水稀释后,溶液中c(NH![]() )·c(OH-)变大
)·c(OH-)变大
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量Na2CO3、NaHCO3组成的混合物溶于水配成50 mL溶液,逐滴加入0.05 mol·L-1盐酸,得到各成分物质的量变化如图所示(已知1 mol=1000 mmol),下列说法不正确的是( )
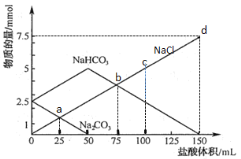
A.a点溶液中Na2CO3与NaCl物质的量相等
B.b点溶液中发生反应的化学方程式为:NaHCO3 + HCl = NaCl+H2O+CO2↑
C.c点溶液中氯化钠的物质的量浓度为0.05 mol·L-1
D.当盐酸加到150 mL时,混合物样品恰好完全反应
查看答案和解析>>
科目: 来源: 题型:
【题目】碘是合成碘化物的基本原料。空气吹出法从卤水中提碘的流程如下:
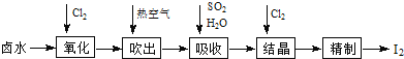
以下说法正确的是( )
A.“氧化”时,须通入过量Cl2保证I-被充分氧化
B.“吹出”操作在吹出塔中进行,应将含碘卤水从塔底进入,热空气从塔顶吹入
C.“吸收”操作中,碘蒸气与二氧化硫水溶液充分接触可生成两种酸
D.“吸收”操作中,含SO2的吸收液也可以用NaOH溶液代替,生成的I-、IO3-经酸化,即可得粗碘。使用NaOH吸收后溶液中I-、IO3-的物质的量之比为1∶5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com